|
 |
| Ann Optom Contact Lens > Volume 22(1); 2023 > Article |
|
Abstract
증례요약:
60세 남성이 3년 전부터 크기가 증가하는 눈꺼풀의 종괴에 대해 타 병원에서 시행한 조직검사 결과 점액샘암종으로 판정되어 내원하였다. 종괴는 진피와 피하지방층에 국한되어 있었으며, 동결절편검사를 통해 병변의 범위를 확인한 뒤 종양제거술을 시행하였다. 면역조직화학검사에서 estrogen receptor (ER), progesterone receptor (PR), cytokeratin (CK)-7 (CK-7) 양성, CK-20은 음성으로 확인되었으며 전신검사에서 전이 소견은 발견되지 않아 눈꺼풀에 발생한 원발점액샘암종으로 진단하였다. 수술 후 병변 주위조직에 보조적 방사선요법을 시행하였으며, 현재 수술 후 12개월간 재발 소견 없이 경과 관찰 중이다.
Abstract
Purpose
We report a case of primary mucinous adenocarcinoma diagnosed in a patient presenting with a mass of the lower eyelid.
Case summary
A 60-year-old man presenting with a mass on the left lower eyelid that had increased in size for 3 years was referred to our center after being diagnosed as mucinous adenocarcinoma. The mass was limited to the dermis and subcutaneous fat layer. The extent of the lesion was confirmed through frozen section examination, and tumor removal was performed. In immunohistochemistry, estrogen receptor, progesterone receptor, and cytokeratin-7 were positive, and cytokeratin-20 was negative. No metastasis was found, so it was diagnosed as primary mucinous adenocarcinoma of the eyelid. After surgery, adjuvant radiotherapy was administered to the tissues surrounding the lesion, and it did not recur during 12 months of follow-up period.
Conclusions:
Primary mucinous adenocarcinoma of the skin, especially of the eyelid, is rare, and it is important to differentiate it from metastatic mucinous adenocarcinoma of other organs. The authors diagnosed primary mucinous adenocarcinoma using immunohistochemistry, and we report how it was successfully treated through surgical excision and reconstruction of the eyelid.
피부의 원발점액샘암종은 1952년 Lennox et al [1]에 의해 처음 보고되었으며, 매우 드물게 발생하는 땀샘 기원의 악성 종양으로 알려져 있다. 병변은 주로 무통성의 결절로 나타나 수개월 또는 수년에 걸쳐 천천히 자라고, 주로 두경부, 그중에서도 눈꺼풀 및 눈썹부위에 가장 흔하게 발생한다[2]. 점액샘암종은 주로 침샘, 유방, 눈물샘, 위장관 등에서 발생하는 경우가 많으며 피부의 원발성 점액샘암종과 조직병리학적으로 매우 유사하기 때문에 진단이 까다롭다. 국내에서 보고된 증례를 보면 보통의 피부색을 띤 불규칙한 결절 모양의 융기된 형태를 보이거나 융기된 것을 제외하면 주변의 피부와 비슷한 표면의 형태를 보이기도 하고 붉은색을 띠고 표면이 매끄러운 낭성종양으로 주변의 피부 조직과 명확히 구분되는 형태를 보이는 등 다양한 형태와 성상을 보이는 편이다[3-5]. 이처럼 원발점액샘암종은 형태학적으로 진단이 되지 않고, 임상적으로 양성 질환과 구분이 어렵기 때문에 반드시 조직학적 확진이 필요하다. 저자들은 기존의 증례와 다른 위치와 형태의 가쪽 아랫눈꺼풀의 무통성 종괴를 원발점액샘암종으로 진단하였으며, 면역조직화학염색 소견을 확인하고 이를 성공적으로 치료했기에 문헌 고찰과 함께 보고하고자 한다.
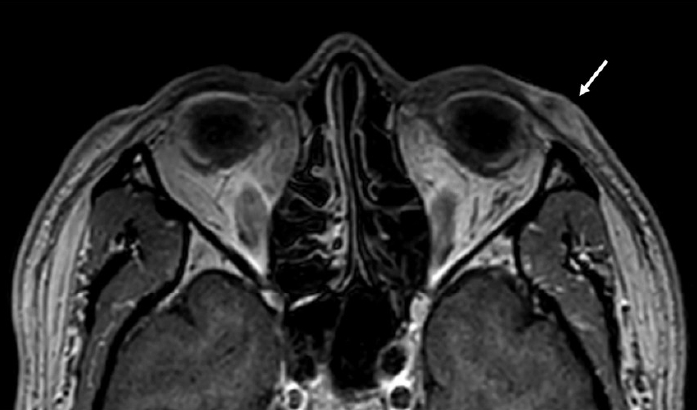
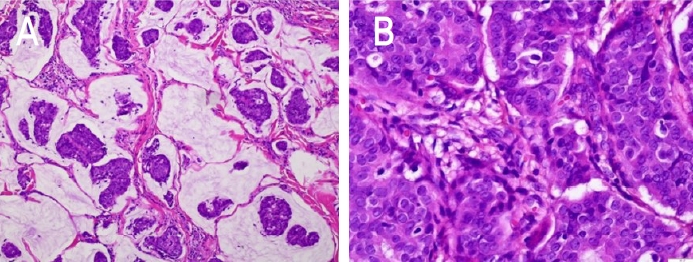
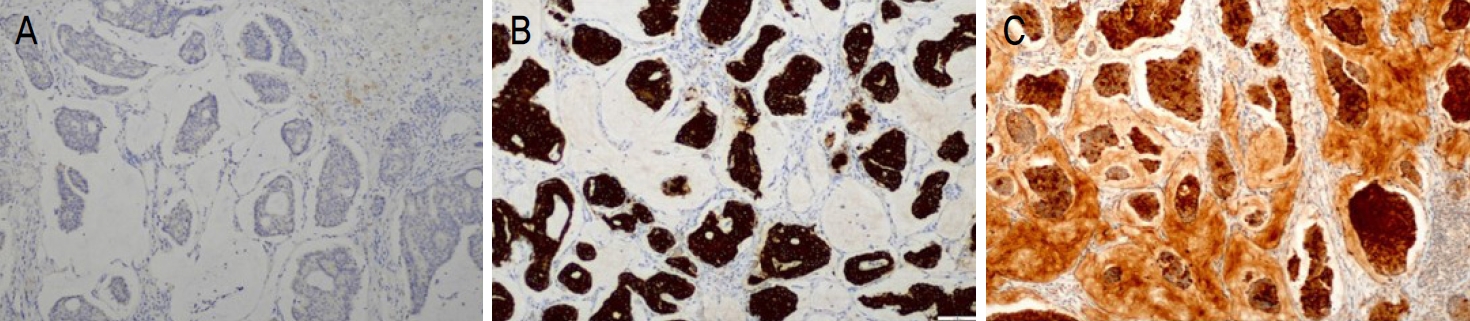
60세 남성이 3년 전부터 크기가 증가하는 좌측 가쪽 아래눈꺼풀의 종괴를 주소로 내원하였다. 내외과적 병력 및 안과적 과거력은 없었다. 신체검진 시 종괴는 지름 1.5 cm의 크기로 경계가 비교적 명확하게 만져졌으며, 압통, 안구 돌출 및 안구운동장애는 보이지 않았다(Fig. 1A). 타 병원에서 시행한 조직검사 결과 뮤신 풀을 형성한 암종으로 확인된 바 있었으며, 본원에서 해당 조직 슬라이드의 재판독 결과 동일 소견이 관찰되었다. 이에 병변의 범위를 정확하게 파악하기 위해 안와 자기공명영상검사를 시행하였고, 왼쪽 가쪽 아래눈꺼풀에 진피와 피하층에 5×14×11 mm 크기로 조영증강되는 종괴가 확인되었다(Fig. 2). 구체적인 진단 및 치료를 위해 전신마취 하에 종양 경계부로부터 3 mm 여유를 두고 국소절제를 시행하였다. 동결 절편에서 변연부가 깨끗한 것을 확인한 뒤, 변형된 마름모 피판을 이용해 연부조직 결손 부위를 재건하였다(Fig. 1B). 떼어낸 종괴는 5.15×11×9 mm 크기로, 병리조직검사 상 림프관 침범 소견이 있었고 눈꺼풀판을 포함하여 안구 주변 구조물로의 침범은 관찰되지 않았다. 절제조직의 현미경 소견에서는 섬유조직에 의해 구획된 뮤신 풀에 종양세포가 다양한 크기로 불규칙한 군집형태를 이루고 있었으며(Fig. 3A), 고배율에서 다형성을 지닌 입방형 종양세포와 핵의 이형성(Fig. 3B)을 관찰할 수 있었다. 면역조직화학염색 검사 결과 cytokeratin 20 (CK-20)는 음성으로 확인되었으며(Fig. 4A) estrogen receptor (ER), progesterone receptor (PR), cytokeratin 7 (CK-7), gross cystic disease fluid protein 15 (GCDFP-15)의 발현을 관찰할 수 있었다(Fig. 4B, C). 또한 수술 후 시행한 흉부, 경부 및 복부 전산화단층촬영, 골스캔, 양전자방출촬영에서는 수술 부위 외 전이 소견을 보이지 않았다. 이에 가쪽 아래눈꺼풀에 원발성으로 발생한 점액샘암종으로 최종 진단하였다. 림프관 침범이 있었던 점과 높은 국소 재발률을 고려하여 방사선종양학과 협진 하 수술 후 주변 조직에 보조적 방사선 치료를 추가로 시행하였다. 이후 수술 후 현재까지 12개월간의 경과 관찰 기간 동안 재발이나 전이는 발생하지 않았다(Fig. 1C).
피부에 발생하는 원발성 점액샘암종은 1952년 Lennox et al [1]에 의해 두피에 발생한 건이 처음 보고되었으며 국내에는 현재까지 5예 보고된 바 있다[3-7]. 60대 남성에서 호발하며, 주로 두경부, 그중에서도 눈꺼풀 및 눈썹부위에 가장 흔하게 발생한다[2,8]. 무통성의 단일 결절로 나타나 수개월 또는 수년에 걸쳐 천천히 자라는 것으로 알려져 있으며, 육안 소견은 다양하게 나타난다. 경계가 명확하고 표면이 매끄러운 경우 낭종, 모반 등 양성 종양으로 오인되기도 하고, 표면이 궤양성 변화를 보이거나 혈관이 두드러져 기저세포암이나 카포시 육종처럼 보이기도 한다[8,9]. 따라서 진단을 위해 조직학적 분석이 매우 중요하다. 종양세포들이 island 형태를 이루어 뮤신 풀(pool)에 떠있는 모습을 볼 수 있으며 얇은 섬유성 격막으로 분리되어 있는 소엽 구조를 형성하기도 한다. 유사분열 수와 핵의 이형성도가 비교적 낮은 것이 특징인데, 이는 진행이 느리고 원격 전이가 적은 특성과 연관된다. 눈꺼풀에 발생하는 원발점액샘암종의 경우 주로 진피와 피하지방층에 국한되나 눈둘레근을 침범하는 경우가 일부 보고된 바 있다. 국소 림프절 전이 및 원격 전이는 드물지만 국소 재발률은 30-40%에 달하는 것으로 알려져 있으며, 원발점액샘암종의 이환율에 있어 가장 중요한 인자는 종양의 불완전한 절제이다[2,10].
점액샘암종이 호발하는 장기는 유방, 위장관, 침샘, 눈물샘, 부비동, 기관지, 난소 등이며, 피부에서 발견되는 경우는 대부분 타 장기들로부터 전이된 경우가 더 많다[9]. 피부에 원발성으로 발생한 점액샘암종과 구별하는 것은 매우 어려운데, 진단을 위해 전산화단층촬영, 양전자방출촬영 등의 전신검사와 더불어 면역조직화학염색법이 보조적으로 사용될 수 있다. 일부 문헌에서 피부의 원발성 점액샘암종에서 ER, PR, GCDFP-15, low-molecular-weight cytokeratin, carcinoembryonic antigen, epithelial membrane antigen, thyroid transcription factor (TTF)-1 (TTF-1), TTF-3이 양성으로 나타나는 것이 보고되었다[9,11,12]. 또한 피부의 원발성 점액샘암종은 CK-7 양성 및 CK-20 음성으로, CK-7 음성 및 CK-20 양성을 보이는 위장관 샘암종과 감별할 수 있다. 다만 유방에서 발생하는 점액샘암종과는 면역조직화학적으로도 매우 유사하고 눈꺼풀로 전이된 예도 있어 더욱 감별이 어렵다[13]. Kazakov et al [13]이 피부를 침범한 점액샘암종 63예를 대상으로 한 연구에 따르면, 유방에서 전이된 경우 주로 흉벽, 유방, 액와부에 피부 병변이 동반된다. 따라서 여성 환자의 경우, 철저한 전신검사와 함께 시진을 포함한 유방암검사가 시행되어야 할 것으로 보인다.
눈꺼풀에 발생한 원발성 점액샘암종의 국소 재발률은 30%를 넘는 것으로 알려져 있으며, 재발 방지를 위해 수술 시 병소의 완전 절제 여부가 중요하다[2,14]. 피부에 발생한 원발성 점액샘암종의 치료 방법으로 면역조직화학염색법을 적용한 Mohs 미세도식수술이 1988년 Marra et al [14]에 의해 처음 도입되었으며, 이후 같은 방법을 이용하여 재발 없이 성공적으로 치료된 증례들이 다수 보고되었다. 현재는 수술 중 동결절편검사를 이용하여 종양의 절제연으로부터 여유를 두고 국소절제술을 시행하는 것이 권유되고 있다. 일반적으로 높은 국소 재발률을 고려하여 1 cm 여유를 두고 절제하는 것이 권고되고 있으나, 병소의 발생 위치 및 크기 등을 고려하여 3-5 mm 가량의 여유를 두고 절제 후 성공적으로 치료된 국내 사례들이 보고된 바 있다[5,7]. 2014년 Kamalpour et al [15]이 전통적인 수술적 절제술 또는 Mohs 미세도식수술로 치료한 159건의 원발성 점액샘암종을 대상으로 시행한 예후 분석에서, 나이가 많은 경우와 인종이 아시아인인 경우가 백인 또는 흑인에 비해 수술 후 재발 또는 전이가 적은 것으로 나타났다. 반면 병소의 크기가 클수록, 술 전 유병 기간이 길수록, 그리고 병소의 위치가 몸통인 경우 예후가 떨어지는 것으로 보고하였다[15]. 본 증례의 경우 종양의 크기가 작은 편이고, 환자 인종, 병소의 위치 등 예후가 좋은 편에 속함을 고려하여 절제연으로부터의 거리를 3 mm 정도로 비교적 좁게 설정하였다.
피부의 원발성 점액샘암종에서 방사선 치료의 효과에 대해서 명확하게 입증된 바는 없다. 항암 치료 및 방사선 치료에 대한 반응은 떨어지는 것으로 알려져 있으나[16], 수술 후 보조적 방사선요법 후 18개월에서 48개월까지 재발하지 않았던 증례들이 보고된 바 있다[17,18]. 본 증례에서도 수술 후 보조적 방사선 치료를 시행하였고 현재 12개월간의 기간 동안 국소 재발 소견 없이 경과 관찰하고 있다. 임상 소견에 따라 보조적 방사선요법을 고려해 볼 수는 있으나, 재발방지 효과 여부에 대해서는 보다 많은 증례들을 대상으로 조사가 필요할 것으로 생각된다.
결론적으로, 피부에 발생하는 원발점액샘암종은 국내에서도 다양한 위치로 보고된 드문 종양으로, 진단 시 타 장기로부터 전이된 점액샘암종과 감별하는 것이 중요하다. 저자들은 본 증례를 통해 원발점액샘암종의 면역조직화학 염색 소견을 대한안과학회지에 처음으로 보고하는 바이며, 또한 수술 후 보조적 방사선요법을 통해 국소 재발률을 낮추고자 시도했다는 것에 의의가 있다. 수술 후에는 장기적인 추적 관찰이 필요하며, 추적 관찰 기간 및 수술 후 보조적 치료 시행 여부에 따른 예후에 대해서 추가적인 연구가 치료 방향 결정에 도움이 될 것으로 생각된다.
Figure 1.
Preoperative and postoperative clinical photo. (A) Palpable mass with a diameter of about 1.5 cm is seen on left lower lid. (B) After wide resection of the mass, reconstruction using modified rhomboid flap was done. (C) Postoperative appearance 1 month after surgery.

Figure 2.
The magnetic resonance imaging of the orbit shows a 5 × 14 × 11 mm extent enhancing lesion (arrow) with skin thickening in dermal/subdermal layer of left lateral lower eyelid.
REFERENCES
1) Lennox B, Pearse AG, Richards HG. Mucin-secreting tumours of the skin with special reference to the so-called mixed-salivary tumour of the skin and its relation to hidradenoma. J Pathol Bacteriol 1952;64:865-80.


2) Wright JD, Font RL. Mucinous sweat gland adenocarcinoma of eyelid: a clinicopathologic study of 21 cases with histochemical and electron microscopic observations. Cancer 1979;44:1757-68.


3) Choi YS, Jung DH, Chi MJ. Primary mucinous adenocarcinoma of the lower eyelid. J Korean Ophthalmol Soc 2022;63:309-13.


4) Hong SM, Kim SD, Yun KJ. A case of primary mucinous adenocarcinoma on skin of the lateral canthus. J Korean Ophthalmol Soc 2009;50:1582-5.

5) Park JM, Kim SS. A case of primary mucinous adenocarcinoma of the lower eyelid. J Korean Ophthalmol Soc 2018;59:176-80.


6) Seo HC, Ahn M, Cho NC, Lee DO. A case of primary mucinous adenocarcinoma of the upper eyelid. J Korean Ophthalmol Soc 2007;48:599-603.
7) Tak MS, Cho SE, Kang SG, et al. Primary cutaneous mucinous carcinoma of the eyelid. Arch Craniofac Surg 2016;17:176-9.




8) Liszauer AD, Brownstein S, Codère F. Mucinous eccrine sweat gland adenocarcinoma of the eyelid. Can J Ophthalmol 1988;23:17-21.

9) Carson HJ, Gattuso P, Raslan WF, Reddy V. Mucinous carcinoma of the eyelid. An immunohistochemical study. Am J Dermatopathol 1995;17:494-8.


11) Ohnishi T, Takizawa H, Watanabe S. Immunohistochemical analysis of cytokeratin and human milk fat globulin expression in mucinous carcinoma of the skin. J Cutan Pathol 2002;29:38-43.



12) Hanby AM, McKee P, Jeffery M, et al. Primary mucinous carcinomas of the skin express TFF1, TFF3, estrogen receptor, and progesterone receptors. Am J Surg Pathol 1998;22:1125-31.


13) Kazakov DV, Suster S, LeBoit PE, et al. Mucinous carcinoma of the skin, primary, and secondary: a clinicopathologic study of 63 cases with emphasis on the morphologic spectrum of primary cutaneous forms: homologies with mucinous lesions in the breast. Am J Surg Pathol 2005;29:764-82.

14) Marra DE, Schanbacher CF, Torres A. Mohs micrographic surgery of primary cutaneous mucinous carcinoma using immunohistochemistry for margin control. Dermatol Surg 2004;30:799-802.


15) Kamalpour L, Brindise RT, Nodzenski M, et al. Primary cutaneous mucinous carcinoma: a systematic review and meta-analysis of outcomes after surgery. JAMA Dermatol 2014;150:380-4.


16) Andrews TM, Gluckman JL, Weiss MA. Primary mucinous adenocarcinoma of the eyelid. Head Neck 1992;14:303-7.


-
METRICS

-
- 0 Crossref
- 0 Scopus
- 995 View
- 17 Download
- Related articles
-
Merkel Cell Carcinoma Localized to Right Lower Eyelid2019 September;18(3)
A Case of Primary Mucinous Adenocarcinoma in Lateral Upper Eyelid2018 September;17(3)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print