|
 |
| Ann Optom Contact Lens > Volume 22(3); 2023 > Article |
|
Abstract
대상과 방법
2021년 4월 19일부터 2022년 11월 30일까지 ARTIS® PL E (A군) 또는 Primus-HD® (B군) 인공수정체로 백내장 수술을 받은 151명의 환자 242안을 후향적으로 분석하였다. 술 후 교정 시력에 영향을 미칠 수 있는 안과 수술, 외상의 과거력 또는 동반된 안과 질환이 있는 눈은 제외되었다. 최종적으로 A군 69안, B군 36안을 분석하였다.
결과
수술 후 3개월 시점에서 logMAR 나안시력(A군과 B군에서 각각 0.15 ± 0.17 및 0.17 ± 0.18, p = 0.60)과 최대 교정 원거리 logMAR 시력(A군과 B군에서 0.03 ± 0.06 및 0.02 ± 0.05)은 유의한 차이가 없었다. 수술 후 중간 거리 및 근거리 나안 시력, 구면렌즈 대응치 및 myopic shift도 두 그룹 간에 유사했다. Barrett Universal II 및 Haigis 공식의 절대오차값은 A군에 비해 B군에서 유의하게 낮았다. 수술 후 3개월 시점에서 두 그룹의 고위 수차 간에는 유의미한 차이가 없었다.
Abstract
Purpose
To compare the clinical outcomes of cataract surgery using the Primus-HD® intraocular lens (IOL) and conventional ARTIS® PL E IOL.
Methods
The study retrospectively enrolled 242 eyes of 151 patients who had undergone cataract surgery with either ARTIS® PL E (Group A) or Primus-HD® (Group B) IOLs between April 19th, 2021 and November 30th, 2022 at Severance Hospital, Yonsei University College of Medicine. Eyes with a history of ocular surgery or trauma or ocular comorbidities that can affect postoperative visual outcomes were excluded. Finally, 69 eyes in group A and 36 eyes in group B were analyzed.
Results
At postoperative 3 months, there was no significant difference in uncorrected (0.15 ± 0.17 vs. 0.17 ± 0.18 in group A and B, p = 0.60) and best-corrected distance visual acuity (0.03 ± 0.06 vs. 0.02 ± 0.05 in group A and B, p = 0.75) between groups A and B. Postoperative uncorrected intermediate and near visual acuity, spherical equivalent and amount of myopic shifting were also similar between the two groups. The mean absolute error of the Barrett Universal II (0.61 ± 0.42 D vs. 0.28 ± 0.17 D in group A and B, p < 0.01) and Haigis (0.51 ± 0.38 D vs. 0.33 ± 0.23 D in group A and B, p = 0.01) formulas were significantly lower in group B compared with group A, showing good predictability. There was no significant difference between the higher order aberrations of the two groups at postoperative 3 months.
백내장 수술 기술의 발전과 인공 수정체의 발달로 오늘 날 백내장 수술은 단순히 백내장만을 제거하는 것이 아니라, 굴절 이상 및 노안의 교정까지 추구하고 있다. 각막이 가진 양의 구면 수차를 교정하기 위해 음의 구면 수차를 가진 다양한 비구면 인공수정체가 개발되어[1,2], 수술 후 고위 수차를 줄이고[3], 특히 동공이 확장되어 있을 때[4] 대비 감도와 시력을 향상시키는 것이[5,6], 백내장 수술의 목표 중 하나로 자리잡았다.
ARTIS® PL E (Cristalens Industrie, Lannion, France)는 기존에 국내에서도 널리 이용된 일체형 비구면 인공수정체로 -0.10 μm의 음의 구면수차값을 가지고 있으며 4개의 고리 모양의 지지부와 6 mm 지름의 광학부로 구성되어 있다[7]. Primus-HD® (Ophthalmo Pro GmbH, Sankt Ingbert, Germany)는 A1-UV (Eyebright Medical Technology Inc, Beijing, China)를 Prosert® (Ophthalmo Pro GmbH) 인공수정체 주입기와 결합시켜 유럽에서 새롭게 출시된 preloaded 인공수정체이다. Primus-HD®는 -0.20 μm의 더 큰 음의 구면 수차를 갖는 소수성 아크릴 비구면 인공수정체이다[8]. 두 인공수정체 모두 2.0 mm 크기의 각막 절개를 통해 이식할 수 있는 preloaded 인공수정체이다(Table 1).
인공수정체는 한번 체내에 삽입하면 대개의 경우 교체하지 않고 평생 보유하게 되는 만큼 백내장 수술 후 인공수정체의 효과, 안전성, 그리고 장기적인 안정성에 대한 관심이 대두되고 있다. A1-UV 인공수정체는 기존의 비구면 인공수정체와 비교하여 수술 후 교정시력과 나안시력은 비슷하지만 인공수정체의 반짝임 변성(glistening) 발생률은 낮다는 연구들이 보고되었다[9,10].
그러나 현재까지 국내외에 Primus-HD® preloaded 인공수정체의 임상적 결과를 보여주는 연구는 없었으며, 따라서 본 연구에서는 기존에 국내에서 널리 사용되던 비구면 preloaded 인공수정체인 ARTIS® PL E와 비교하여 이 새로운 인공수정체의 임상 결과를 평가하고자 한다.
이 연구는 단일센터에서 진행된 후향적 연구로 연세대학교 의과대학 부속 세브란스병원 임상시험심사위원회(Institutional Review Board)와 윤리위원회의 심사를 승인(승인 번호: 4-2023-0051) 받았으며, 헬싱키 선언을 준수하여 수행되었다. 비식별화된 환자 데이터를 사용한 후향적 연구로, 연구 참여에 대한 환자 동의는 면제되었다. 2021년 4월 19일부터 2022년 11월 30일까지 연세대학교 의과대학 부속 세브란스병원에서 단일 술자(IJ)에 의해 ARTIS® PL E (A군) 또는 Primus-HD® (B군) 인공수정체를 이용해 백내장 수술을 받은 환자들이 연구에 포함되었다.
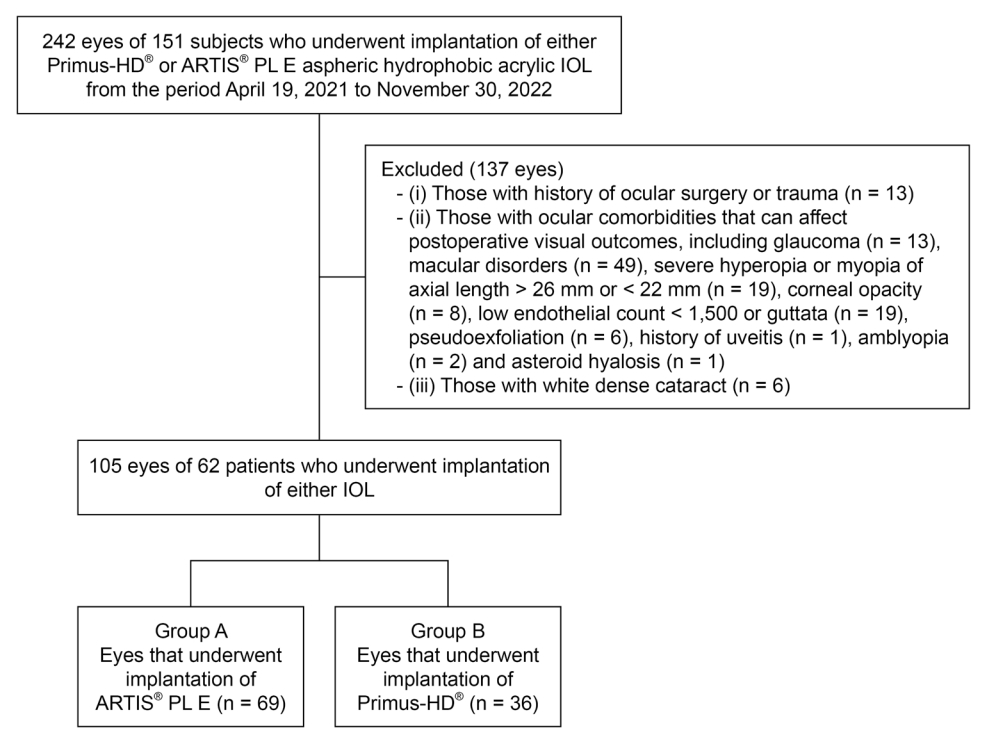
50세 이상의 노년성 백내장[11] 환자들이 연구에 포함되었다. (1) 안구 수술 또는 외상(n = 13)의 병력, (2) 녹내장(n = 13), 황반질환(n = 49), 안축장 26 mm 초과 또는 22 mm 미만의 심한 근시와 원시(n = 19), 각막 혼탁(n = 8), 1,500 미만의 낮은 내피 세포 수 또는 심한 구타타(n = 19), 거짓비늘증후군(n = 6), 포도막염(n = 1), 성상유리체증(n = 1), 약시(n = 2) 등 수술 후 시력예후에 영향을 줄 수 있는 안과적 과거력, 그리고 (3) 백색 백내장(n = 6)이 있는 눈은 연구에서 제외되었다(Fig. 1).
수술 전 검사는 양 군에서 모두 동일하게 시행되었으며 세극등 및 안압 검사, 나안시력, 최대교정시력, 현성굴절검사, 안저검사, 각막내피세포검사, 각막지형도검사(Pentacam HR; Oculus, Wetzlar, Germany) 및 안구수차검사(Tracey Technologies Corp., Houston, TX, USA)가 이에 포함되었다. 고위수차의 root mean square 값과 트레포일 수차, 코마 수차, 구면 수차는 4 mm 동공에서 측정되었다[12]. 인공수정체 도수는 IOL Master-700 (Carl Zeiss Meditec, Oberkochen, Germany)를 이용하여 측정하고 목표 디옵터는 SRK/T, Barrett Universal II 및 Haigis 공식을 사용하여 계산하였다. SRK/T 공식으로 계산한 목표 디옵터를 기준으로 근시가 -0.25 D에 가장 근접한 IOL을 택하였다.
수술 후 검사는 수술 후 1일, 1주, 1개월, 그리고 3개월째에 시행되었으며, 나안 원거리(3 m) 시력, 안압, 세극등검사, 자동각막 굴절검사를 포함하였다. 수술 후 1개월 및 수술 후 3개월차 검사에는 나안 중간거리 시력(66 cm)과 근거리 시력(33 cm), 현성 굴절법을 이용한 최대 교정 원거리 시력, iTrace® (Tracey Technologies Corp., Houston, TX, USA)를 이용한 각막수차측정 및 각막내피세포수 검사가 포함되었다. 수술전에 계산된 목표 디옵터와 수술 후 3개월째에 굴절률을 비교하여 평균오차와 평균 절대오차를 계산하였으며, 평균 오차는 수술 후 3개월째 굴절률에서 각 공식으로 계산한 목표 디옵터를 뺀 값의 평균으로, 평균 절대오차는 수술 후 3개월째 굴절률에서 각 공식으로 계산한 목표 디옵터를 뺀 값의 절대값의 평균으로 계산하였다.
A군의 43명 69안, B군의 19명 36안을 대상으로 하였다. 수술 중 혹은 수술 후 합병증은 두 그룹 모두에서 관찰되지 않았다. A군의 평균 연령은 73.29 ± 8.03세였으며 B군의 평균 연령은 74.83 ± 5.43세로 양 군 간 유의한 차이가 없었다(Table 2). 연령, 성별, 수술 전 나안 원거리 시력, 최대교정 시력, 구면 렌즈 대응치, 안축장, 전방 깊이(Table 2), 고위수차(Table 3) 또한 두 군 간에 유의한 차이가 없었다.
수술 후 3개월 시점에서 양 군의 임상적 결과는 Table 4에 나타나 있다. 수술 후 3개월 시점에 나안 원거리 시력(A군과 B군에서 각각 0.15 ± 0.17 및 0.17 ± 0.18, p = 0.60), 최대 교정 원거리 시력(A군과 B군에서 각각 0.03 ± 0.06 및 0.02 ± 0.05, p = 0.75), 나안 중간 거리 및 근거리 시력에는 두 군 간의 유의미한 차이가 없었다(Table 4). 수술 후 굴절력(A군과 B군에서 각각 -0.16 ± 0.85 D 및 -0.47 ± 0.66 D, p = 0.10) 및 난시 굴절값(A군과 B군에서 각각 -0.43 ± 0.45 D 및 -0.43 ± 0.56 D, p = 0.96) 또한 두 군 간의 차이가 없었다. A군에서 수술 후 1개월에 굴절률과 비교하여 수술 후 3개월에는 0.03 ± 0.34 D만큼 원시 방향으로 굴절률이 이동한 반면, B군에서는 3개월차에 -0.07 ± 0.30 D만큼 근시 방향으로 굴절률이 이동한 것을 확인할 수 있었으나 유의미한 차이는 없었다(p = 0.19) (Table 4).
수술 후 3개월 차에 SRK/T 공식의 평균오차(A군과 B군에서 각각 0.26 ± 0.53 및 -0.08 ±0.42, p < 0.01) 및 Barrett Universal II 공식의 평균오차(A군과 B군에서 각각 0.53 ±0.53 및 -0.03 ±0.33, p < 0.01)는 A군에 비해 B군에서 유의하게 작았다. Haigis 공식에 대한 평균오차는 두 그룹 간에 유의미한 차이가 없었다. 반면, 평균 절대오차의 경우 Barrett Universal II (수술 후 3개월째에 A군과 B군에서 각각 0.61 ± 0.42 D 및 0.28 ± 0.17 D, p < 0.01)와 Haigis (수술 후 3개월째에 A군과 B군에서 각각 0.51 ± 0.38 D 및 0.33 ± 0.23 D, p = 0.01) 모두 A군에 비해 B군에서 유의미하게 낮았다(Table 4).
B군 내에서는 수술 후 3개월째에 Barrett Universal II 공식이 SRK/T 공식보다 예측력이 유의미하게 더 높았다(Barrett Universal II 및 SRK/T 공식의 절대 오차값 각각 0.28 ± 0.17 및 0.36 ± 0.22, p = 0.02). Haigis 공식의 예측력은 SRK/T (p = 0.67) 및 Barrett Universal II (p = 0.11) 공식과 유사했다(Table 4).
연구에 포함된 모든 환자의 모든 안에서 수술 전, 수술 후 1개월, 수술 후 3개월 고위수차 측정을 시행하였다. 수술 후 3개월 시점에서 안구 전체 수차, 구면수차 및 코마수차는 두 군 간에 유의한 차이가 없었다(Table 3). 안구 내 구면수차의 교정량(수술 후 안구 내 구면수차와 수술 전 안구 내 구면수차의 차이)은 A군에서 0.00 ± 0.45, B군에서 -0.10 ± 0.45로 나타났으나 두 군 간에 유의미한 차이는 없었다(p = 0.37).
중국에서 진행된 몇몇 기존 연구에서는 A1-UV 인공수정체가 근거리 및 원거리 나안 시력, 최대 교정시력, 대비 민감도, 주관적 만족도 측면에서 기존에 안정성이 검증된타 비구면 인공수정체와 차이가 없음을 입증했다[9,10,13]. 그러나 현재까지 국내외에서 Primus-HD® preloaded 인공수 정체의 임상 결과를 다른 인공수정체와 비교한 국내 및 국제적 보고는 없었다.
본 연구에서 Primus-HD® 인공수정체를 이용한 백내장 수술이 기존에 효능과 안전성이 확립된 비구면 단초점 인공수정체인[14] ARTIS® PL E를 이용한 백내장 수술과 유사한 결과를 보여주었다. 두 인공수정체 모두 preloaded 인공수정체로, 수술 중 인공수정체 삽입에 소요되는 시간을 단축시키고, 인공수정체 장착 중 발생 가능한 광학부 긁힘 및 오염을 방지하는 것으로 알려져 있다[15,16].
예측성 측면에서는 Barrett Universal II와 Haigis 공식 모두 평균 절대오차 값이 A군에 비해 B군에서 유의미하게 낮아 우수한 예측성을 보였다. ARTIS® PL E 인공수정체를 삽입한 백내장 수술에서는 SRK/T, Barrett Universal II 및 Haigis 공식으로 계산한 목표 디옵터에 비해 실제 수술 후 굴절률이 원시에 가깝게 나타난 반면, Primus-HD® 인공수정체를 이용한 백내장 수술을 받은 환자는 세 가지 공식으로 계산된 목표 디옵터와 비교하여 실제 굴절률은 더 근시에 가깝게 나타났다.
인공수정체 광학부의 전후방 움직임은 백내장 수술 후 굴절 안정성에 중요한 요소이며, 이로 인해 백내장 수술 후 굴절력이 근시 혹은 원시로 이행할 수 있다[17,18]. 이 연구에서 수술 후 3개월 평가에서 ARTIS® PL E 및 Primus-HD® 인공수정체 모두 유의미한 굴절력의 변화가 관찰되지 않았다.
비구면 인공수정체는 수술 후 안구 내 구면 수차를 음의 값으로 만들어 각막의 양의 구면수차를 상쇄함으로써 안구 전체 구면수차를 0에 가깝게 유지하도록 설계되어 있다[2,19]. Primus-HD® 인공수정체의 자체적인 구면수차 값은 -0.20 μm로 ARTIS® PL E 인공수정체 -0.10 μm에 비해 크며, 본 연구에서도 백내장 수술 전 후 안구 내 구면수차의 교정량은 A군에서 0.00 ± 0.45, B군에서 -0.10 ± 0.45 (p = 0.37)로 Primus-HD®로 인한 안구 내 구면수차 교정량이 -0.10 μm 더 큰 것을 확인할 수 있었으나, 유의미한 차이는 없었다.
한편, 본 연구에서는 A, B군 모두 수술 후 각막 구면수차의 값이 수술전에 비해 감소한 것으로 나타났는데(Table 3), 이는 A군에서 69.6%, B군에서 61.1%의 환자가 백내장 수술과 동시에 펨토초레이저를 이용한 궁상절개술을 시행받은 것과 연관이 있을 것으로 생각된다(Table 2). 펨토초레이저를 이용한 궁상절개술이 구면수차에 미치는 영향은 정립된 바가 없다. 한 연구에서는 백내장 수술과 동시에 펨토초레이저를 이용한 궁상절개술을 시행받은 환자들에서 수술 2개월 후 각막 구면수차의 값이 수술 전과 비교하여 소폭 감소 경향을 보였으나, 유의미한 차이는 없었다[20].
단초점 인공수정체를 이용한 백내장 수술 후에는 근거리 시야 확보를 위해 돋보기가 필요하지만, 상대적으로 비용이 저렴하고 원거리에서 우수한 결과를 얻을 수 있으며 후광이나 눈부심의 발생률이 낮기 때문에 여전히 널리 사용되고 있다[21,22]. 이 연구는 Primus-HD® 인공수정체가 단초점 인공수정체를 이용한 백내장 수술을 예정하고 있는 환자에게 좋은 대안이 될 수 있음을 보여준다. Primus-HD® 인공수정체는 수술 후 원거리 나안시력, 최대교정시력, 고위 수차, 술후 근시 변화부분에서 기존에 안정성이 검증된 ARTIS® PL E 인공수정체와 비슷한 결과를 보여주었고, 수술 후 구면렌즈대응치에 대한 예측력 면에서는 더 나은 예측력을 보여주었다.
본 연구의 제한점은 첫째, 제한적인 대상자 수에 대해 후향적으로 진행된 연구이기 때문에 더 많은 환자에 대한 전향적 연구가 필요할 것으로 생각된다. 둘째, 3개월간 추적 관찰을 진행하였기 때문에 더 장기간 추적관찰을 시행한 연구가 필요할 것으로 생각된다. 셋째로, 본 연구는 안축장이 22.0 mm과 26.0 mm 사이인 환자만을 대상으로 하였으므로, 안축장이 짧거나 긴 환자의 목표 디옵터 계산에 대한 추가 연구가 필요하다.
본 연구는 국내외 최초로 Primus-HD® 인공수정체의 임상 결과에 대해 보고한 연구로, Primus-HD® 인공수정체는 기존에 임상효과가 검증된 ARTIS® PL E 인공수정체와 비교하여 수술 후 1개월, 3개월의 시력 및 고위수차 측면에서 유사한 임상적 결과를 나타냈으며, 수술 후 구면렌즈대응치에 대한 예측력 면에서는 더 나은 예측력을 보여주었음을 확인하였다. 따라서 preloaded 비구면 단초점 인공수정체를 사용한 백내장 수술을 계획할 때 Primus-HD® 인공수정체가 안전하고 효과적인 후보로 사용될 수 있음을 알 수 있다.
Notes
This work was supported by a faculty research grant of Yonsei University College of Medicine [grant number 6-2020-0222], the Basic Science Research Program (NRF-2021R1I1A1 A01047951) of the National Research Foundation (NRF), and by the Korean Fund for Regenerative Medicine (KFRM) grant (KFRM 22C0615L1) funded by the Korean Gov-ernment (the Ministry of Science and ICT, the Ministry of Health & Welfare).
Table 1.
Optical characteristics of the aspherical IOLs used in the study
Table 2.
Baseline characteristics of patients who received cataract surgery with ARTIS® PL E or Primus-HD® intraocular lens
Table 3.
Ocular aberrations and corneal spherical aberrations (μm) measured by iTrace® aberrometer at postoperative 3 months
| Evaluation time-points | IOL type | Total Ocular HOA | Ocular Spherical aberration (Z40) | Corneal spherical aberration | Internal spherical aberration | Vertical coma aberration (Z3-1) | Horizontal coma aberration (Z31) | Oblique trefoil aberration (Z3-3) | Horizontal trefoil aberration (Z33) |
|---|---|---|---|---|---|---|---|---|---|
| Preoperative | ARTIS® PL E | 0.94 ± 0.63 | 0.23 ± 0.41 | 0.24 ± 0.30 | -0.01 ± 0.49 | 0.00 ± 0.61 | 0.15 ± 0.61 | -0.17 ± 0.35 | 0.01 ± 0.59 |
| Primus-HD® | 0.85 ± 0.56 | 0.27 ± 0.41 | 0.19 ± 0.18 | 0.07 ± 0.39 | -0.19 ± 0.38 | -0.02 ± 0.33 | -0.01 ± 0.34 | 0.02 ± 0.21 | |
| p-value | 0.51 | 0.62 | 0.40 | 0.49 | 0.08 | 0.12 | 0.02* | 0.94 | |
| Postoperative 3 months | ARTIS® PL E | 0.55 ± 0.84 | 0.02 ± 0.14 | 0.03 ± 0.05 | -0.02 ± 0.14 | 0.07 ± 0.43 | -0.05 ± 0.33 | -0.16 ± 0.42 | 0.05 ± 0.44 |
| Primus-HD® | 0.62 ± 0.96 | 0.02 ± 0.17 | 0.05 ± 0.39 | -0.03 ± 0.16 | -0.11 ± 0.28 | -0.02 ± 0.25 | -0.22 ± 0.60 | -0.02 ± 0.28 | |
| p-value | 0.73 | 0.97 | 0.13 | 0.62 | 0.06 | 0.66 | 0.62 | 0.44 |
Table 4.
Clinical outcomes and predictability of ARTIS® PL E and PRIMUS-HD® intraocular lens at postoperative 3 months
| Variable | ARTIS® PL E (n = 69) | Primus-HD® (n = 36) | p-value |
|---|---|---|---|
| UCVA (3 m, logMAR) | 0.15 ± 0.17 | 0.17 ± 0.18 | 0.60 |
| UIVA (66 cm, logMAR) | 0.26 ± 0.18 | 0.25 ± 0.16 | 0.68 |
| UNVA (33 cm, logMAR) | 0.42 ± 0.19 | 0.46 ± 0.17 | 0.30 |
| BCVA (at 3 m) | 0.03 ± 0.06 | 0.02 ± 0.05 | 0.75 |
| Endothelial cell count | 2,355.44 ± 411.93 | 2,350.67 ± 339.83 | 0.96 |
| Spherical equivalent (D) | -0.16 ± 0.85 | -0.47 ± 0.66 | 0.10 |
| Refractive cylinder (D) | -0.43 ± 0.45 | -0.43 ± 0.56 | 0.96 |
| Myopic shift† (D) | 0.03 ± 0.34 | -0.07 ± 0.30 | 0.19 |
| Mean numerical error (D) | |||
| SRK/T | 0.26 ± 0.53 | -0.08 ± 0.42 | < 0.01* |
| Barrett Universal II | 0.53 ± 0.53 | -0.03 ± 0.33 | < 0.01* |
| Haigis | 0.35 ± 0.53 | 0.17 ± 0.37 | 0.12 |
| Mean absolute error (D) | |||
| SRK/T | 0.46 ± 0.36 | 0.36 ± 0.22 | 0.12 |
| Barrett Universal II | 0.61 ± 0.42 | 0.28 ± 0.17 | < 0.01* |
| Haigis | 0.51 ± 0.38 | 0.33 ± 0.23 | 0.01* |
REFERENCES
1) Smith G, Cox MJ, Calver R, Garner LF. The spherical aberration of the crystalline lens of the human eye. Vision Res 2001;41:235-43.


2) Packer M, Fine IH, Hoffman RS. Aspheric intraocular lens selection: the evolution of refractive cataract surgery. Curr Opin Ophthalmol 2008;19:1-4.


3) Pérez-Merino P, Dorronsoro C, Llorente L, Durán S, Jiménez-Alfaro I, Marcos S. In vivo chromatic aberration in eyes implanted with intraocular lenses. Invest Ophthalmol Vis Sci 2013;54:2654-61.


4) Lasta M, Miháltz K, Kovács I, Vécsei-Marlovits PV. Effect of spherical aberration on the optical quality after implantation of two different aspherical intraocular lenses. J Ophthalmol 2017;2017:8039719.




5) Sandoval HP, Fernández de Castro LE, Vroman DT, Solomon KD. Comparison of visual outcomes, photopic contrast sensitivity, wavefront analysis, and patient satisfaction following cataract extraction and IOL implantation: aspheric vs spherical acrylic lenses. Eye (Lond) 2008;22:1469-75.



6) Kershner RM. Retinal image contrast and functional visual performance with aspheric, silicone, and acrylic intraocular lenses. Prospective evaluation. J Cataract Refract Surg 2003;29:1684-94.

7) CRISTALENS. ARTIS® PL E monofocal hydrophobic lens preloaded [Internet]. Lannion: CRISTALENS; 2018 [cited 2023 Feb 20]. Available from: https://cristalens.fr/artis-pl-e/.
8) Ophthalmo Pro GmbH. Primus-HD® Yellow; 1 step preload in perfection [Internet]. Sankt Ingbert: Ophthalmo Pro GmbH; 2018 [cited 2023 Feb 20]. Available from: https://ophthalmo-pro.de/en/primus-hd/.
9) Liao X, Li JY, Tan QQ, Tian J, Lin J, Lan CJ. Comparison of visual quality after implantation of A1-UV and SN60WF aspheric intraocular lens. Int J Ophthalmol 2020;13:1727-32.



10) Song XD, Hao YS, Li XR, et al. [Safety and efficacy of A1-UV aspheric intraocular lens implantation over the postoperative 5 years]. Zhonghua Yan Ke Za Zhi 2021 57:41-7. Chinese.

11) Rochtchina E, Mukesh BN, Wang JJ, McCarty CA, Taylor HR, Mitchell P. Projected prevalence of age-related cataract and cataract surgery in Australia for the years 2001 and 2021: pooled data from two population-based surveys. Clin Exp Ophthalmol 2003;31:233-6.


12) Faria-Correia F, Lopes B, Monteiro T, Franqueira N, Ambrósio R Jr. Scheimpflug lens densitometry and ocular wavefront aberrations in patients with mild nuclear cataract. J Cataract Refract Surg 2016;42:405-11.


13) Qian JL, Liao X, Tang YL, Tan QQ, Zhou GM, Lan CJ. [Comparative study of decentration, tilt and visual quality after implantation of aspherical intraocular lenses]. Zhonghua Yan Ke Za Zhi 2022 58:521-8. Chinese.

14) Park ESY, Chung BH, Jun I, Kim Ti, Seo KY, Kim EK. Clinical results of cataract surgery using the ARTIS® PL E intraocular lens. J Korean Ophthalmol Soc 2022;63:134-41.


15) Jones JJ, Chu J, Graham J, Zaluski S, Rocha G. The impact of a preloaded intraocular lens delivery system on operating room efficiency in routine cataract surgery. Clin Ophthalmol 2016;10:1123-9.


16) Chung B, Lee H, Choi M, Seo KY, Kim EK, Kim TI. Preloaded and non-preloaded intraocular lens delivery system and characteristics: human and porcine eyes trial. Int J Ophthalmol 2018;11:6-11.


17) Lee JM, Oh TH, Kim HS. The changes in anterior chamber depth and refractive error associated with diverse intraocular lenses. J Korean Ophthalmol Soc 2013;54:245-50.

18) Olsen T, Corydon L, Gimbel H. Intraocular lens power calculation with an improved anterior chamber depth prediction algorithm. J Cataract Refract Surg 1995;21:313-9.


19) Kim SW, Ahn H, Kim EK, Kim TI. Comparison of higher order aberrations in eyes with aspherical or spherical intraocular lenses. Eye (Lond) 2008;22:1493-8.



20) Chan TC, Ng AL, Cheng GP, Wang Z, Woo VC, Jhanji V. Corneal astigmatism and aberrations after combined femtosecond-assisted phacoemulsification and arcuate keratotomy: two-year results. Am J Ophthalmol 2016;170:83-90.


-
METRICS

-
- 0 Crossref
- 0 Scopus
- 872 View
- 23 Download
- Related articles
-
Clinical Outcomes of Superflex<sup>®</sup> Large Optic Intraocular Lens2016 December;15(4)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print