서 론
발전된 광학 기술인 적응광학기술(adaptive optics, AO)은 안구의 광학 수차를 교정함으로써 다양한 망막단층의 조직학적인 구조와 모양까지 관찰이 가능하게 한 기술이다. 1997년에 Liang et al [1]에 의해 처음 개발된 AO는 섬광을 이용하여 안저를 촬영하였으나 산란되는 빛이 하나의 이미지에 모두 반영되어 영상의 해상도를 저하시키는 문제가 있었다. 2002년 Roorda et al [2]은 AO를 공초점주사레이저검안경검사(confocal scanning laser ophthalmoscope, SLO)에 결합하여 AO-SLO를 만들었다. 이는 감지기 앞에 공초점 핀홀을 위치시켜 촬영하고자 하는 부분이 아닌 망막의 다른 부분에서 나오는 산란되는 빛을 방지하여, 이전 모델의 단점을 극복하였다. AO-SLO의 주요 장점은 원치 않는 면에서 나오는 빛을 제거하여 고해상도 영상을 얻고, 원하는 부분의 단층을 관찰할 수 있는 축 방향 스캔이 가능하다는 점과 검사 중에 AO-SLO 영상을 실시간으로 볼 수 있다는 것이다. 이를 이용해 모세혈관 내 백혈구 이동과 같은 영상을 얻을 수 있으며 실시간으로 검사자가 영상을 확인할 수 있어 영상의 질을 향상시킬 수 있다. AO-SLO와 형광안저혈관촬영술(fluorescence angiography, FAG)을 조합한 AO-SLO FAG는 더 미세한 혈관구조를 밝히는 데에 성공하기도 하였으며, 빛간섭단층촬영(optical coherence tomography, OCT)과 조합한 다른 AO 형태인 AO-OCT를 이용해 약 3 μm의 해상도까지 망막의 미세구조영상을 얻을 수도 있다. 이를 통하여 지금까지 다른 영상을 통해서는 관찰하지 못하였던 망막혈관의 변화, 드루젠 및 경성 삼출물, 연성 삼출물의 변화 등을 더 명확하게 관찰하고 세분화하여 분석하고, 망막 질환의 병태생리를 밝히는 데 많은 도움을 주고 있다[3-7].
비록 국내에서는 아직까지 연구가 진행되지 않고 있으나, 현재 미국, 일본을 중심으로 전 세계적으로 AO를 활용하여 연구가 진행되고 있다. 현재 AO-SLO의 한계점은 촬영 시간이 길고, 고도의 원시나 각막혼탁, 백내장, 황반부종 및 출혈 등이 있는 경우 촬영이 제한적이라는 것이다. 또한 아직까지 분석 소프트웨어의 정확도에 관하여도 논란이 있다. 그러나 살아있는 인체 내에서 비침습적으로 광수용체를 관찰할 수 있다는 큰 장점으로, 추후 질병의 조기 진단, 경과, 치료의 초기 효과, 병리 등을 밝히는 데에 있어 새로운 방향을 제시할 것으로 보인다[8].
본 론
AO의 원리
AO는 안구의 파면을 교정함으로써 다양한 망막단층의 조직학적인 구조와 모양까지 관찰이 가능하게 한 기술이다. 본래 안과 영역이 아닌 천문학의 영역에서 별을 관측할 때 대기 등을 포함한 비균질 매질에 의한 광학 수차를 교정하여 고해상도의 이미지를 얻는 데에 사용되었다. 안과적으로도 눈에서 발생하는 광학 수차를 인식하고 교정하여 고해상도의 이미지를 얻게 된다.
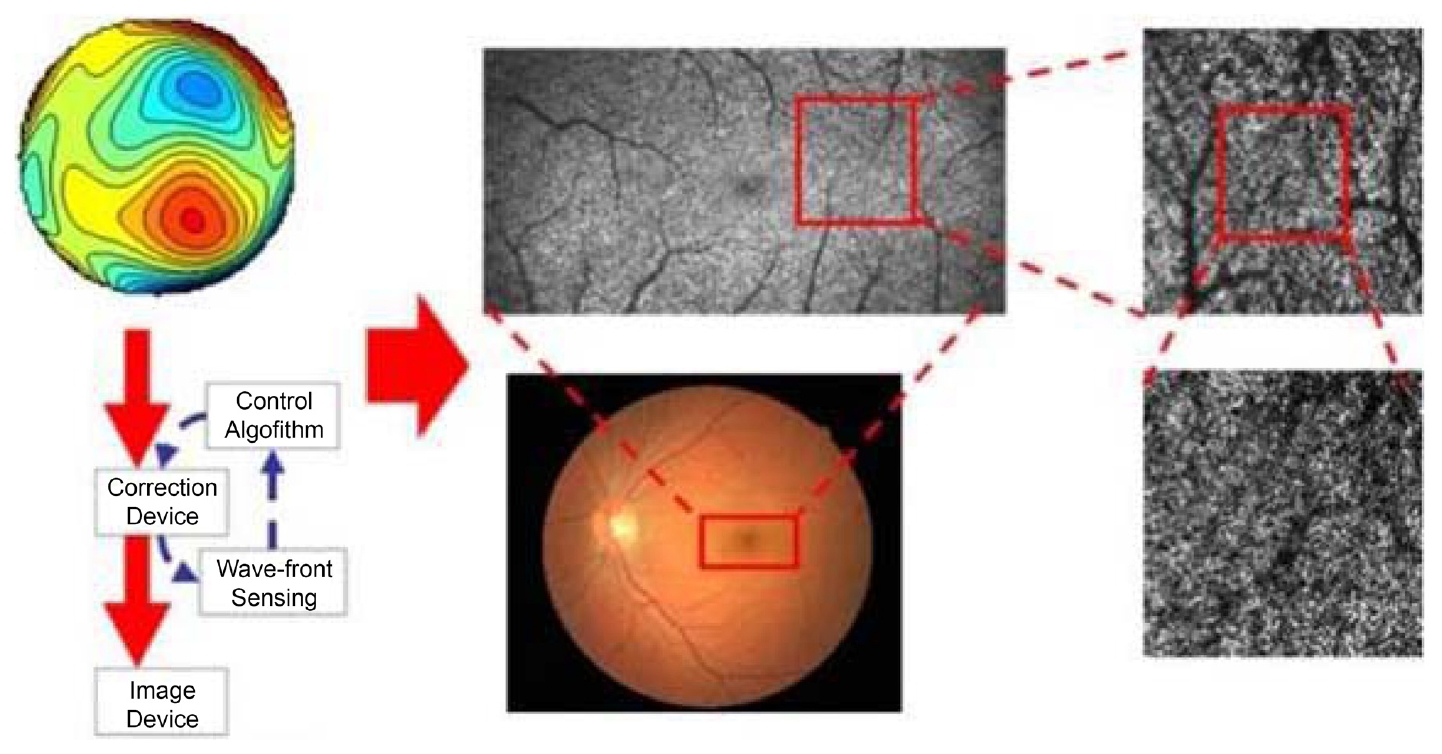
AO는 기본적으로 wavefront sensor, corrective element, 그리고 control system, 이렇게 세 가지로 구성되어 있다. Wavefront sensor란 각막의 구면 수차를 측정하는 데에 쓰이며, 가장 많이 사용되는 것은 Shack-Hartmann wavefront sensor이다. 이 장비는 레이저를 반사경으로 눈에 조사한 다음 반사되어 나오는 레이저의 파면을 전하결합소자(charge coupled device) 카메라로 측정하는 원리로, 일반적인 눈에서 생기는 초점은 그 축에 맞춰서 생기게 되지만 수차를 가진(aberrated) 눈에서는 축에 빗나가게끔 초점이 생겨서 축에서 벗어난 정도에 따라서 수차를 측정하게 된다. Corrective element (the “adaptive” optical element)란 AO의 개발 초기부터 많이 사용되었던 변형거울(deformable mirror)로 구동부(actuator)들이 움직이면서 거울의 표면을 변형시켜 파면을 교정하여 내보내게 된다[9-11]. 세 번째로 software system은 중간에서 조정하는 controller 기능을 하며, wavefront sensor에서 측정한 구면 수차를 보정 장치를 사용하여 보정하는 것을 반복하는 폐쇄 루프(closed loop) 역할을 하여, 고해상도의 이미지를 얻게 된다(Fig. 1) [12,13].
AO를 활용한 망막 이미지 촬영(adaptive optics retina imaging system)
AO는 이전부터 널리 이용되어 온 SLO, OCT, FAG 등과 성공적으로 접목되어 더욱 효과적으로 사용되고 있다.
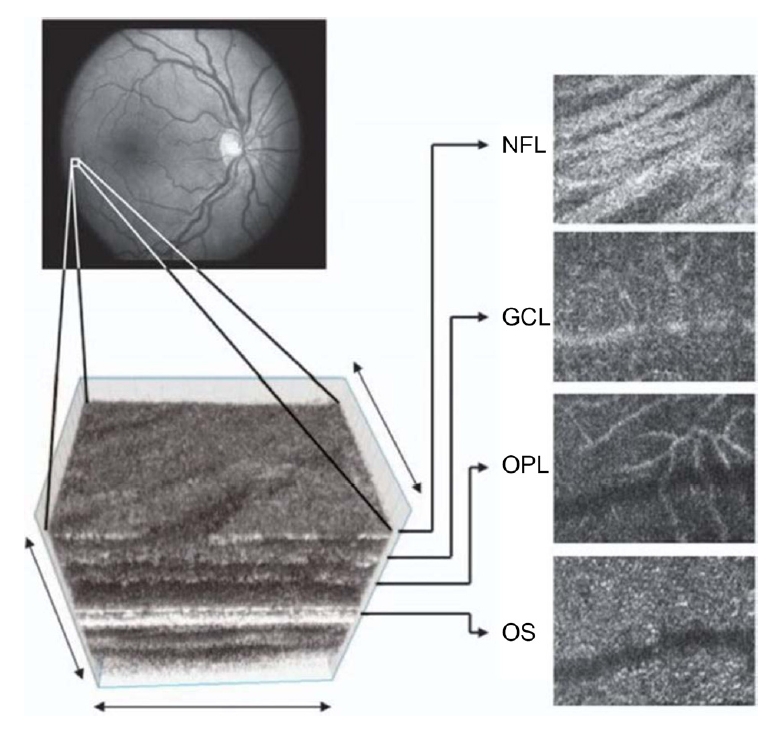
AO-SLO
2002년 Roorda et al [2]은 AO의 투광 조명(flood illumination)에 썼던 AO 기술을 SLO에 결합하여 AO-SLO를 개발하였다. 공초점능(confocality)은 AO-SLO의 가장 큰 장점으로, 기존과 같은 스냅샷(snapshot) 형식이 아닌 래스터(raster) 방식으로 이미지를 얻게 되면서 원치 않는 면에서 나오는 빛을 제거할 수 있게 되어 이미지의 대비도와 해상도가 좋아질 수 있다는 장점이 있다. 또한, 원하는 면만 볼 수 있으므로 축 방향 스캔이 가능하다(Fig. 2). 예를 들면, 공초점 핀홀을 최적화할 경우 6 mm 동공과 600 nm 조건에서 측면과 축 방향 해상도는 각각 1.9 μm와 33 μm에 달하며[14], 이를 이용하여 망막을 층별로 세분화하여 관찰하는 것이 가능하다[15]. Fig. 3에서 보는 바와 같이 시세포 층은 다른 망막층에 비하여 산란이 더 많이 되어 AO-SLO에서의 관찰이 더 용이하다. 게다가 단층화를 이용하여 나이관련황반변성(age-related macular degeneration, AMD) 등 드루젠과 관련하여 시세포층의 동반된 변화를 가져오는 다양한 질환을 연구하는 데에 도움을 받을 수 있다[3,4]. 또한 신경섬유층의 관찰을 통하여 신경섬유의 녹내장성 변화를 평가하는 좋은 도구로 평가되기도 하였다[16,17]. AO-SLO는 망막시세포층과 신경섬유층 사이의 혈관을 관찰하는 데도 유용하게 사용될 수 있는데, 이때 혈액과 혈관에 의해 긴 파장의 빛은 흡수되며 중심와 주변 모세혈관의 적혈구와 백혈구의 움직임에 의한 이미지만 시간에 따른 다양성을 가지며 얻어지기 때문에, 조영 증강 없이 중심와 주변 모세혈관망을 포함한 중심와 무혈관 부위를 면밀하게 관찰할 수 있다[18-20]. AO-SLO를 이용한 망막색소상피의 세포 모자이크는 원뿔막대세포이상증과 그 외에 진행성 망막증에서 망막색소상피의 소실이 관찰되면서 주목받기 시작하였다[21]. 초창기 정상 망막에서 시세포 뒤에 위치하는 망막상피세포를 관찰하는 것은 쉽지 않았으나, 최근 전위 산란 광자 이미지(forward scattered photons imaging)를 이용한 비공초점 이미지를 통하여 시세포에 의해 가려진 망막색소상피 혹은 신경섬유층에 의해 가려진 혈관을 관찰하는 것이 가능해졌다[22,23]. 또한 AO-SLO는 시선 추적이 가능할 뿐만 아니라 실시간으로 자극의 깊이를 변경하며 다중채널 이미지를 얻을 수 있다는 장점이 있다.
AO-OCT
1991년 처음 개발되어 빠르게 발전한 OCT는 SLO와 달리 측면과 축 방향의 해상도가 분리되어 있으며, 광원의 대역폭이 넓을수록 더 좋은 해상도를 가지게 된다. 중심파장이 증가할수록 광원의 대역폭은 감소하는 데에 비하여, 같은 축 방향의 OCT 해상도에 필요한 대역폭이 증가하게 된다. 또한 인간의 눈은 색에 따른 파장마다 다른 층에 초점이 맞춰지는 종축의 색 수차를 지니고 있는데, 이러한 이유 등으로 OCT의 측면 해상도는 제한을 가지게 된다[24,25]. 반면 AO는 단색 수차를 교정할 수 있기 때문에 측면 해상도를 향상시켜 OCT의 해상도를 증가시킬 수 있다[26,27]. 이러한 시스템을 이용하여 각각의 시세포들을 3차원으로 재구성할 수 있으며[28], 최근 고속 AO-OCT (초당 120,000 scans)를 이용하여 신경섬유층, 신경절세포와 사상판을 비롯한 망막색소상피모자이크와 맥락막모세혈관까지도 3차원으로 재구성하여 관찰 가능해졌다[29]. AO가 적용되지 않았던 스펙트럼영역 OCT에서는 스캔 중 망막 움직임(intra scan retinal motion)에 의한 이미지 뒤틀림에 의하여 주변부 원뿔세포의 모자이크만 얻을 수 있었으나 AO의 적용과 함께 초고속 AO-OCT (초당 300,000 A-scans)가 가능해지면서 중심부 원뿔세포의 관찰이 가능해졌다(Fig. 4) [30].
AO-SLO FAG
현재까지 망막혈관질환의 진단과 치료 후 평가에 있어 FAG가 임상적으로 중요하게 사용되고 있으나, 조영제 사용에 따른 전신 부작용으로 인한 단점은 극복되지 못하고 있는 실정이다. 또한 축에 따른 해상도 제한으로 인하여 망막 표층모세혈관층(superficial capillary plexus)과 심부모세혈관층(deep capillary plexus)의 구분이 어렵다는 단점을 가지고 있다. 최근 개발된 AO-SLO FAG는 형광 물질을 경구 복용하여 이전 정맥주사하였던 방법에 비하여 덜 침습적이고 부작용이 적으며 구조적, 기능적 관류 영상뿐 아니라 모세혈관의 벽과 같은 미세구조 관찰이 가능하다. 또한, 이와 관련된 AO-SLO 오프셋 핀홀 기법은 움직임 보정 기법(motion contrast processing techniques)을 통하여, 형광물질의 도움 없이도 미세혈관 구조 영상을 얻을 수 있다[31]. 이와 같은 AO-SLO 이미지 기법의 발달로 인하여, 덜 침습적인 방법으로 정상 망막뿐 아니라 고혈압이나 당뇨를 가진 환자들에게서 발생하는 망막혈관의 미세 변화 또한 관찰이 용이해졌다(Fig. 5).
임상 망막에서 AO의 활용
원뿔세포의 모자이크 이미지(imaging the cone photoreceptor mosaic)
원뿔 세포의 독특한 웨이브가이드(waveguiding) 특성에 의해서 AO의 초창기 때부터 많은 연구가 이루어질 수 있었다. 1996년 안저 카메라와 함께 설치된 AO에 의하여 처음 원뿔세포의 모자이크 이미지가 얻어졌고[32], 첫 번째 AO-SLO 원뿔세포의 모자이크 영상이 발표되었으나 이는 단순한 원뿔세포 모자이크 위치에 따른 밀도 분석에 그쳤다. 이후 많은 연구자들이 질병이 있는 눈과의 비교를 위한 정상안 데이터 구축을 시행하였으며, 원뿔세포의 수가 망막 중심에서 멀어질수록 유의하게 줄어들며 그 배열이 동공 중심을 향해 밀도 있게 배열되어 있다는 특징 등을 밝혀내었다. 뿐만 아니라 나이나 성별, 우세안에 따른 차이는 없지만, 안축장이 길어질수록 그 수가 유의하게 감소한다는 특징 등을 발견하였다[2,13,33]. Dhiman et al [34]은 AO를 이용한 선천 적녹색맹과 정상안을 비교 연구를 통해 원뿔세포의 분산(cone dispersion)을 제외한 밀도, 규칙성 등 다른 해부학적 특징이 비슷함을 확인하였다(Fig. 6).
유전성 망막변성증
유전성 망막변성증은 시세포의 점차적인 소실을 유발하는 유전질환으로 현재 치료나 진행을 늦추기 위한 확실한 치료 방법은 없으나 줄기세포 혹은 유전자 단계에서의 치료가 개발되고 있다[35-37]. 이에 따라 이전 OCT를 비롯한 이전 영상 기술에서는 제한적이었던 시세포 각각의 변화를 관찰할 수 있는 AO는 진단과 연구에 매우 이상적이다[38]. 망막색소변성(retinitis pigmentosa, RP), 막대원뿔세포이상증 등은 막대세포의 광범위한 소실을 나타내며, 주변 시야의 감소 및 야맹증을 유발한다. 반면 원뿔막대세포이상증은 원뿔세포 먼저 소실되게 되어 중심시력의 저하, 색각저하 등이 먼저 나타나게 된다. AO는 원뿔세포와 막대세포의 직접적인 형태 관찰에 용이하기에 이를 이용한 연구는 이들 질병의 경과와 병리를 밝히는 데 크게 기여하였다. 원뿔막대세포이상증 환자에서 망막의 반흔과 위축 부위와 일치하는 원뿔세포의 어두운 부분이 관찰되었으며[30], 주변망막의 원뿔세포는 정상세포보다 더 커져 있는 모습을 보였다. 또다른 연구에서 관찰한 바에 의하면, 원뿔세포의 밀도가 감소된 부위에서 국소 망막전위도의 파형이 감소하고 시각의 민감도가 감소하는 소견을 보였다[39]. 또한, RP 환자와 원뿔막대세포이상증 환자에서 다른 형태의 원뿔세포 소실을 보이는데, 전자의 경우 막대세포가 밀집한 지역 부근의 원뿔세포부터 소실되나, 후자의 경우 중심부 원뿔세포부터 소실되게 된다[40,41]. Park et al [42]이 발표한 X염색체 관련 RP 보인자로 특별한 안과적 증상이 없고 정상시력을 가진 여자 환자들을 분석한 연구에 의하면, OCT에서 뚜렷한 장애를 보이기 전부터 원뿔세포의 밀도가 감소하고, 비정상 원뿔세포의 분포가 증가했다. 또한 상염색체 우성 RHO, D190N 유전자 보인자들을 대상으로 한 연구에서도 OCT에서 망막 구조에 이상이 없음에도 불구하고 원뿔세포의 형태 이상이 나타났다(Fig. 7) [30]. 단순 RP 환자와 어셔증후군(Usher syndrome) 환자를 대상으로 원뿔세포의 변화를 관찰한 또 다른 연구에 의하면, 중심와와 중심와 부근 모두 어셔증후군의 원뿔세포 소실이 더 빠르게 일어났다[43]. 이와 같이 OCT나 FAG에서 발견되지 않은 시세포의 변화가 발견된 예는 급성후부다발판모양색소상피증에서도 AO-SLO 이미지를 이용해 보고된 바 있다[30]. 이를 통해 중심시력저하, 망막전위도검사, OCT에서 변화가 나타나기 전부터 원뿔세포의 밀도 변화를 관찰하는 것이 가능해짐으로써 병의 발생과 진행을 좀 더 민감하게 관찰할 수 있음을 알 수 있게 되었다[38,44]. 또한 2011년 Talcott et al [44]은 RP 환자들을 대상으로 한 모양체신경영양인자(ciliary neuro trophic factor)의 치료 효과에 대한 임상 시험에서 시야검사, 망막전위도검사에서는 유의한 차이가 없었으나, AO-SLO를 이용해 원뿔세포의 밀도를 측정하여 밀도 감소 속도가 유의하게 적음을 보고하였다. 최근에는 빛간섭단층촬영혈관조영술(optical coherence tomography angiography, OCTA)과 AO를 통한 안저사진을 함께 비교하여, 원뿔세포 밀도가 감소한 중등도 및 중증 RP 환자의 심부모세혈관총에서 미세혈관의 밀도가 감소함을 확인하였다[45].
당뇨와 망막혈관질환
최근 AO-SLO를 이용하여 모세혈관의 관찰이 용이해지면서 당뇨로 인한 미세혈관 구조와 허혈성 변화에 대한 많은 연구가 이루어졌다. 2011년 Tam et al [46]은 AO-SLO를 이용하여 당뇨망막병증이 없는 2형 당뇨 환자들의 중심와 무혈관 부위에 대해 고해상 이미지를 통한 구조적, 기능적 분석을 시행하였다. 그 결과, 혈류 속도, 중심와 무혈관 부위의 면적, 모세혈관의 밀도 등은 대조군과 유의하지 않은 차이를 보인 반면, 중심와 무혈관 부위의 모세혈관의 비틀림은 대조군에 비하여 더 큰 변화가 관찰되었다. 또한 백혈구가 혈관의 비틀림이 더 적은 혈관을 선호하여 지나기에 비틀림이 심한 혈관들에서는 점차 탈락하게 된다는 것을 바탕으로, 당뇨 환자에서의 중심와 무혈관 부위의 증가, 미세혈관류, 면화반과 같은 허혈성 변화를 설명하는 모델을 제시하였다. 또한, 2014년 Burns et al [47]은 경도, 중증도 비증 식당뇨망막병증 환자들을 대상으로 AO-SLO를 통하여 혈관의 리모델링과 미세혈관 변화의 정량적 분석을 시행하였다. 연구 결과에 의하면, 당뇨망막병증 환자군에서 중심와 무혈관 부위의 모세혈관 내경이 정상군에서 보다 유의하게컸으며(8.2 ± 1.1 μm vs. 6.1 ± 0.75 μm), 소동맥에서는 정상보다 두꺼운 혈관벽(1.1 ± 0.87 μm vs. 0.42 ± 0.28 μm)이, 그리고 보다 큰 벽 내강 비율(wall-to-lumen ratio)이 관찰되었다. 2019년 Palochak et al [48]은 초기 당뇨 환자를 대상으로 OCTA와 AO-SLO를 이용한 연구에서, 당뇨망막병증이 없는 환자에서는 망막혈액 속도와 혈류 흐름이 빠르고 OCTA에서의 혈관밀도가 높은 데 비해 경도의 당뇨망막병증 환자에서는 이 지표들이 감소한다는 것을 확인하고 이 것이 당뇨망막병증의 진행 정도 예측에 활용할 수 있다는 가능성을 시사하였다. 2014년 Dubow et al [49]은 미세혈관류의 진행과 전신질환과의 연관성에 착안하여, 당뇨 혹은 다른 망막혈관질환에서 AO-SLO FAG를 통하여 보다 많고 다양한 형태의 미세혈관류를 분류하여 보여주었다. 또한 중심망막정맥폐쇄가 있는 한 환자에서 항혈관내피성장인자 치료를 통한 미세혈관류 감소를 보여주었고, 이와 연관된 다른 보고에서는 같은 환자의 미세혈관류를 AO 이미지를 이용하여 5가지 방법으로 보여주었다[31]. 이 연구들은 AO 이미지를 통하여 혈관의 변화들을 더 나은 방향으로 이해하고 시간의 흐름에 따른 변화를 더 잘 이해할 수 있는 좋은 예시를 보여주고 있다. AO 이미지 없이 제공이 불가능한 이와 같은 매우 정밀한 측정은 질환의 초기의 변화를 알려주는 구조적 변화나 질환의 진행 그리고 치료에 대한 반응을 보여주는 생물학적 지표를 제공해줄 것으로 기대된다.
나이관련황반변성
비신생혈관성 AMD는 50세 이상 성인에서 시력저하의 가장 흔한 원인이며, 전 세계적으로 성인 유병률이 20% 이상으로 추정되고 있다. AMD는 망막색소상피와 브루크막 사이에 드루젠의 축적과 동시에 외망막층과 망막색소상피, 맥락막위축이 진행하는 질병으로, 높은 유병률로 많은 연구가 이루어지고 있으나 아직 질환의 병태생리와 진행 과정은 알려진 바가 적다[50]. 최근 질환의 병태생리를 이해하는 데에 있어 AO-SLO를 이용한 관련 연구들이 활발히 진행되고 있다. 2013년 Zayit-Soudry et al [4]은 AO-SLO를 이용하여 AMD 환자들의 안저 변화를 주기적으로 관찰하여 결과를 발표하였다. 이들은 드루젠과 지도 모양 위축 부위에서 원뿔세포 손상의 특징에 대하여 연구하였으며, 원뿔세포 형태의 일부가 비정상 형태를 보이지만 망막색소상피층에서 원뿔세포 수와 밀도가 지속적으로 감소하는 반면, 원뿔세포 소실 부위가 지속적으로 증가하지는 않았다고 발표하였다. 이는 비신생혈관성 AMD 환자에서 원뿔세포의 소실이 망막상피세포 소실과 같은 주변 구조의 변화로 인하여 발생하는 것에 기인하기 때문으로 추정된다고 덧붙였다[44]. 또한 2013년 Rossi et al [51]에 따르면 AO-SLO FAG 이미지를 통해 망막색소상피의 경우 시세포와 다르게 더 빠른 변화가 일어난다는 것을 알 수 있었다. 반면 2014년 Zhang et al [5]에 의하면 망상형 가성 드루젠에서는 원뿔세포의 형태가 더 빠른 변화와 소실을 나타내며, 이는 전형적인 드루젠과 달리 가성 드루젠은 시세포 바로 아래에 위치하는 것과 연관되어 있다. 또한 최근 AO 안저 카메라에 의해지도 모양 위축 부위 주변에 멜라닌 과립세포의 이동이 관찰되면서 질병 진행 예측인자로서의 가능성이 제시되었다[52]. 최근 AO-SLO를 이용한 망막하드루젠형침착(subretinal drusenoid deposit, SDD)에 대한 연구가 이루어졌는데, AO-SLO를 통해 SDD가 있는 외망막의 비율을 계산하여 시간에 따른 진행 정도를 확인함으로써, SDD 또한 진성 드루젠과 같이 생성-진행-소멸의 역동성을 가지며 주변부 광수용체의 손실을 유발함을 보였다[53]. 또 다른 연구에서는 SDD 아형분류를 통해 점형 SDD와 리본형 SDD로 구분하여, AO-SLO로 촬영한 리본형 SDD 주변의 광수용체 이미지 가시성이 점형 SDD의 것에 비해 낮음을 확인하였고, 이는 향후 AMD 예후와 관련이 있다고 밝혔다[54].
황반원공
황반원공이란 특발성 혹은 이차적으로 발생하는 중심와의 망막 조직 전층 결손으로, 내경계막 제거와 가스 주입을 포함한 유리체절제술을 통하여 90% 이상의 해부학적 원공폐쇄를 보이는 질환이다[55]. 그러나 일부 환자들은 수술 후에도 지속적인 시력저하, 변시증, 중심암점 등을 호소하며, 고해상도 OCT 등 영상기술의 발달과 이와 관련된 망막단층의 수술 전후 해부학적 변화에 대한 연구가 활발히 이루어지고 있다. 2012년 Ooto et al [56]은 AO-SLO와 OCT, 미세시야계검사 등을 통하여 황반원공수술 후 중심와 해부학적 변화와 기능적 변화의 관련성을 연구하였다. 결과적으로 수술 후 AO-SLO에서 관찰된 중심와의 어두운 영역의 넓이는 중심시력(p=0.003) 및 중심와 민감도(p=0.006)와 반비례 관계에 있었으며, 이는 수술 전 유병 기간과 유의한 상관성을 보였다(p<0.001). 또한 2013년 Yokota et al [57]에 의하면 수술 후 관찰되는 중심와의 어두운 영역은 광수용체 내외절경계부(photoreceptor inner segment/outer segment junction, IS/OS junction)의 균열과 연관이 있었으며, 중심와 원뿔세포 소실 비율이 클수록 수술 후 중심시력(p<0.001)과 중심와 민감도(p=0.029)가 유의하게 낮았다. 2011년 Bottoni et al [58]은 고해상도 OCT를 이용하여 수술 후 황반원공의 회복 기전 모델을 제시한 바 있다. 2019년 Markan et al [59]은 성공적인 황반원공수술을 받은 환자들을 대상으로 처음으로 AO를 이용하여 광수용체를 분석하였다. 수술 6개월 후 중심와로부터 2º 떨어진(eccentricity) 범위, 특히 하측과 이측 사분면에서 광수용체 밀도가 유의하게 낮아진 것을 확인하였고, 이와 같은 황반으로 세포의 재분배를 통해 해부학적으로 정상 배열되었다. 다만 정상 세포수에 비해 황반부로 이동한 세포수가 적지만, 특이하게 낮은 세포 밀도에도 불구하고 정상안과 비교하여 시력은 잘 나온 것으로 보아 원뿔세포의 절대값과 시력이 직접적인 연관을 갖지는 않는 것으로 보이며, 추후 세포의 배열, 주변 세포와의 연관성 등에 관한 연구가 필요해 보인다.
망막전막
망막전막(epiretinal membrane, ERM)은 고령에서 가장 흔한 유리체 황반 질환으로, 영상 기술의 발달로 인하여 이전에는 관찰되지 않았던 병리학적 구조의 관찰이 가능해졌으며, 이와 관련하여 질환의 병태 생리를 이해하고 수술 시기를 결정하며 수술 전후 망막 상태를 평가하는 것이 매우 용이해졌다[60]. 2011년 Ooto et al [61]은 특발성 ERM 환자 24명, 25안을 대상으로 주관적인 변시증 정도와 OCT에서 관찰되는 망막구조 변화와 함께 AO-SLO에서의 시세포의 구조 변화를 분석하였다. 결과적으로 OCT에서 측정된 IS/OS junction의 분열 여부는 ERM 환자의 변시증이나 시력과 연관이 없는 반면, AO-SLO에서 관찰된 마이크로폴드(Micro-folds, 시세포 층에서 관찰되는 다수의 얇은 저형광직선)의 유무는 변시증과 큰 연관을 보였다. 이를 바탕으로 2016년 Lombardo et al [60]은 특발성 ERM 환자 6명의 수술 전후 망막 상태를 비교 분석하였다. 수술 전 AO-SLO 이미지에서 관찰되는 세 가지 특징적 구조로 매크로폴드(Macro-folds), Micro-folds, 과반사 구조물(Hyper-reflective structure)이 있는데, Macro-folds의 경우 OCT에서 관찰되는 망막 주름의 구조와 일치하는 형태를 보였으며 수술 후 모든 환자에서 크게 감소하는 경향을 보였다. Micro-folds의 경우 OCT에서는 관찰되지 않는 구조로, 이 구조를 바탕으로 ERM을 황반부를 방사상 형태로 덮고 있는 방사형(radial type)과 다양한 각도로 가로지는 형태의 주름을 형성하는 격자형(grid type)으로 분류하였다. 위와 같은 구조의 면밀한 관찰은 현재 망막 전문의들에게 큰 관심사인 내경계막제거술 여부와 ERM 재발의 연관성에 대한 답변을 제시하는 데에 도움을 줄 것으로 생각된다. Hyper-reflective structure의 경우 Scoles et al [62]이 이와 같은 구조를 보이는 망막질환 및 신경질환을 7개의 카테고리로 분류하여 보고한 바 있으며, 저자들은 이 분류가 같은 병태생리를 가진 질환에서 유사한 형태를 보인다고 하였다.








 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Download Citation
Download Citation Print
Print