|
 |
| Ann Optom Contact Lens > Volume 21(3); 2022 > Article |
|
Abstract
Ļ░Ćņŗ£ņĢäļ®öļ░ö Ļ░üļ¦ēņŚ╝ņØĆ ņŗ¼ĒĢ£ Ļ▓ĮņÜ░ Ļ░üļ¦ē Ēś╝ĒāüņØä ļé©Ļ▓© ņśüĻĄ¼ņĀü ņŗ£ļĀźņĀĆĒĢśļź╝ ņĢ╝ĻĖ░ĒĢĀ ņłś ņ׳ļŖö ņ¦łĒÖśņ£╝ļĪ£, ļīĆļČĆļČä ņĮśĒāØĒŖĖļĀīņ”ł ņ░®ņÜ®Ļ│╝ Ļ┤ĆļĀ©ļÉśņ¢┤ ļ░£ņāØĒĢśļŖöļŹ░, ņĄ£ĻĘ╝ ņĮśĒāØĒŖĖļĀīņ”ł ņé¼ņÜ®ņ×ÉņØś ņ”ØĻ░ĆņÖĆ ļŹöļČłņ¢┤ ļ░£ņāØļÅä ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŗż. ļłłņŚÉ ļ│┤ņØ┤ļŖö ņåīĻ▓¼ņŚÉ ļ╣äĒĢ┤ ņŗ¼ĒĢ£ ĒåĄņ”Ø, ļ░®ņé¼Ļ░üļ¦ēņŗĀĻ▓ĮņŚ╝, Ļ│Āļ”¼ļ¬©ņ¢æņ╣©ņ£żņØ┤ ļ╣äĻĄÉņĀü ĒŖ╣ņ¦ĢņĀüņØĖ ņ”ØņāüņØ┤ļéś, ņ×äņāüņŚÉņä£ ļ╣äņĀäĒśĢņĀüņØĖ ņ”ØņāüņØä ļ│┤ņŚ¼ ņ¦äļŗ©ņØ┤ ļŖ”ņ¢┤ņ¦ĆļŖö Ļ▓ĮņÜ░Ļ░Ć ņ׳ļŗż. ņ¦äļŗ©ņØĆ Ļ░üļ¦ē Ļ▓Ćņ▓┤ņŚÉņä£ Ļ░Ćņŗ£ņĢäļ®öļ░ö ņśüņ¢æĒśĢņØ┤ļéś ĒżļéŁņØä ĒÖĢņØĖĒĢśļŖö Ļ▓āņØ┤ļéś, ĒśäņŗżņĀüņ£╝ļĪ£ ņé¼ņÜ®ĒĢśĻĖ░ ņ¢┤ļĀżņÜ┤ Ļ▓ĮņÜ░ņŚÉļŖö ņ×äņāü ņåīĻ▓¼ņØä ĒåĄĒĢ┤ ļ╣ĀļźĖ ņ¦äļŗ©Ļ│╝ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśļŖö Ļ▓āņØ┤ ņśłĒøäņŚÉ ņżæņÜöĒĢśļŗż. ļ│ĖĻ│ĀņŚÉņä£ļŖö ņé¼ņ¦äņØä ĒåĄĒĢ£ Ļ░Ćņŗ£ņĢäļ®öļ░ö Ļ░üļ¦ēņŚ╝ņØś ļŗżņ¢æĒĢ£ ņ×äņāü ņåīĻ▓¼Ļ│╝ ņ╣śļŻīņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
Abstract
Acanthamoeba keratitis (AK) is a vision-threatening corneal infection that most frequently affects contact lens wearers. Severe pain out of proportion to the corneal findings, radial keratoneuritis, and ring infiltration are relatively specific clinical manifestations of AK. The diagnosis of AK is challenging and it is often misdiagnosed because of atypical presentations. The definitive diagnosis of AK requires the presence of Acanthamoeba cysts or trophozoites in corneal lesions, and a high index of clinical suspicion is important for early diagnosis. In this review, we describe the clinical manifestations, including atypical findings, and management of AK.
Ļ░Ćņŗ£ņĢäļ®öļ░ö(Acanthamoeba)ļŖö ņśżņŚ╝ļÉ£ ļ¼╝Ļ│╝ ĒåĀņ¢æņŚÉņä£ ĒØöĒ׳ ļ░£Ļ▓¼ļÉśļŖö ņøÉņāØļÅÖļ¼╝ļĪ£[1], Ļ░Ćņŗ£ņĢäļ®öļ░ö Ļ░üļ¦ēņŚ╝(Acanthamoeba keratitis)ņØĆ ļīĆļČĆļČä ņĮśĒāØĒŖĖļĀīņ”ł ņ░®ņÜ®Ļ│╝ Ļ┤ĆļĀ©ļÉśņ¢┤ ļ░£ņāØĒĢśĻ│Ā, ņ¦äļŗ© ņŗ£ĻĖ░ņŚÉ ļö░ļØ╝ ņśłĒøäĻ░Ć ļŗżļź┤ĻĖ░ ļĢīļ¼ĖņŚÉ[2], ņĮśĒāØĒŖĖļĀīņ”ł ņ░®ņÜ®ņ×ÉņŚÉņä£ ņ”Øņāü ļ░£Ēśä ņŗ£ ņØśņŗ¼ĒĢśņŚ¼ ļ╣ĀļźĖ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļŗż[3]. Ļ░Ćņŗ£ņĢäļ®öļ░ö Ļ░üļ¦ēņŚ╝ņØś ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ņ×äņāü ņåīĻ▓¼ņØä ņżæņŗ¼ņ£╝ļĪ£ ņ¦äļŗ©Ļ│╝ ņ╣śļŻīņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
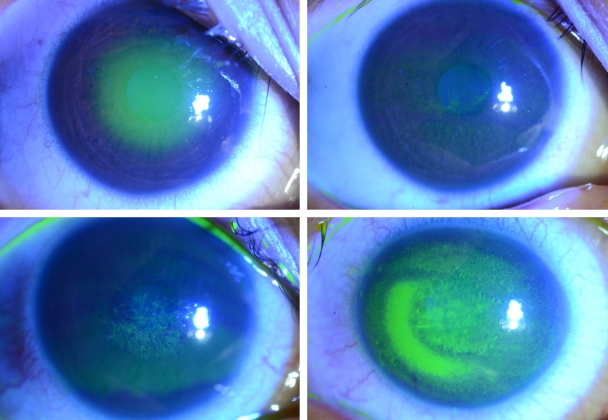
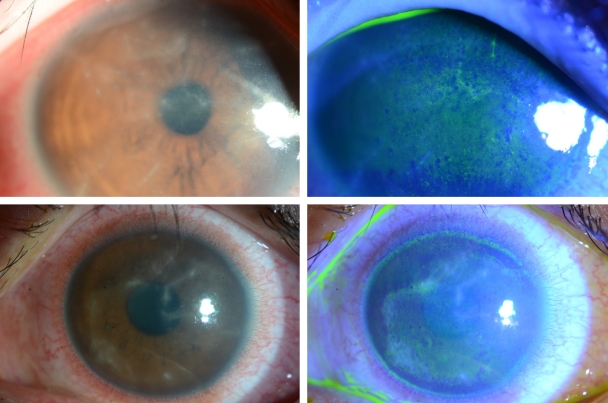
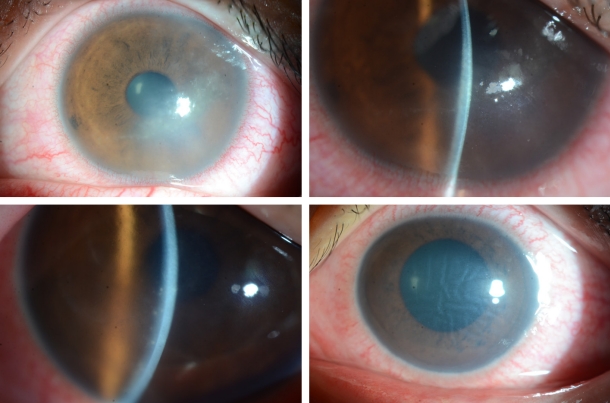
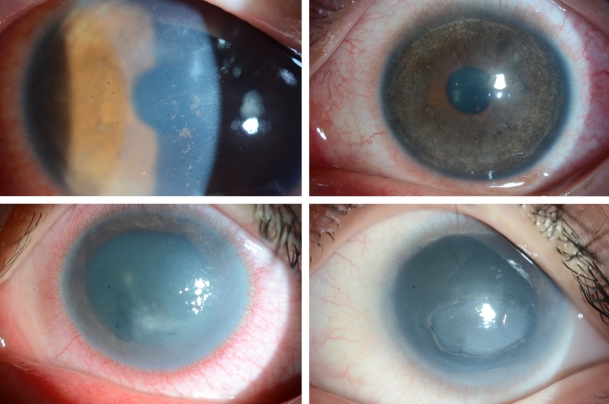
Ļ░Ćņŗ£ņĢäļ®öļ░ö Ļ░üļ¦ēņŚ╝ņØĆ ļīĆĻ░£ ļŗ©ņĢłņŚÉ ņØ┤ĒÖśļÉśļéś, ņ¢æņĢłņŚÉ ņØ┤ĒÖśļÉ£ Ļ▓ĮņÜ░Ļ░Ć 6.6%ņśĆļŗżļŖö ļ│┤Ļ│ĀļÅä ņ׳ļŗż[4]. ĒŖ╣ņ¦ĢņĀüņØĖ ņ”ØņāüņØĆ ŌĆśļłł ņåīĻ▓¼ņŚÉ ļ╣äĒĢ┤ ņŗ¼ĒĢ£ ĒåĄņ”ØŌĆÖņ£╝ļĪ£, Ļ░Ćņŗ£ņĢäļ®öļ░ö ņśüņ¢æĒśĢ(trophozoites)ņØ┤ Ļ░üļ¦ēņŗĀĻ▓ĮņäĖĒż ņ╣£ĒÖöļĀźņØ┤ ņ׳ņ¢┤ ņŗĀĻ▓ĮņäĖĒżņé¼ļ®ĖņØ┤ļéś ņäĖĒżņ×Éļ®Ėņé¼ļź╝ ņØ╝ņ£╝ĒéżĻĖ░ ļĢīļ¼ĖņŚÉ ņāØĻĖ░ļéś, ĒåĄņ”ØņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ļÅä ņ׳ļŗż[5]. ņ┤łĻĖ░ņŚÉ ņāüĒö╝ ļ│æļ│ĆņŚÉ ĻĄŁĒĢ£ļÉĀ Ļ▓ĮņÜ░ ņĀÉļ¬©ņ¢æĻ░üļ¦ēļ│æņ”Ø(punctate keratopathy)ņØ┤ļéś Ļ▒░ņ¦ōĻ░Ćņ¦Ćļ¬©ņ¢æ(pseudodendrites)ņØä ļ│┤ņØ┤ĻĖ░ļÅä ĒĢśņŚ¼(Fig. 1), Ļ░üļ¦ēņ¦äļ¼┤ļ”äņØ┤ļéś ļŗ©ņł£Ēżņ¦äĻ░üļ¦ēņŚ╝ņ£╝ļĪ£ ņśżņ¦äĒĢĀ ņłś ņ׳ļŗż. Ļ░Ćņŗ£ņĢäļ®öļ░öĻ░Ć ņŗĀĻ▓ĮņäĖĒż ņŻ╝ļ│ĆņŚÉ ļ¬©ņŚ¼ ņŚ╝ņ”ØņØä ņ£Āļ░£ĒĢśļŖö ļ░®ņé¼Ļ░üļ¦ēņŗĀĻ▓ĮņŚ╝(radial keratoneuritis)ņØĆ 60% ņØ┤ņāüņŚÉņä£ ļ░£Ļ▓¼ļÉśļ®░ ļ╣äĻĄÉņĀü ĒŖ╣ņ¦ĢņĀü ņåīĻ▓¼ņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ¢┤ ņ×äņāüņĀü ņ¦äļŗ©ņŚÉ ļÅäņøĆņØä ņŻ╝ļéś(Fig. 2), ņ┤łĻĖ░ļČĆĒä░ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ņŚÉ Ļ░Éļ│äņØ┤ ņ¢┤ļĀżņÜĖ ņłś ņ׳ļŗż. Ļ░Ćņŗ£ņĢäļ®öļ░öĻ░Ć ņĀÉņ░© ņŗżņ¦łļĪ£ ņ╣©Ēł¼ĒĢśņŚ¼ ņŗ¼ĒĢ£ ņŚ╝ņ”ØņØä ņ£Āļ░£ĒĢśļ®┤, Ļ│Āļ”¼ļ¬©ņ¢æņ╣©ņ£ż(ring infiltration)ņØ┤ ļéśĒāĆļé£ļŗż(Fig. 3). ņŗżņ¦ł ņŚ╝ņ”ØņØ┤ ņŗ¼ĒĢ┤ņ¦ĆĻ│Ā, Ļ░üļ¦ēĒøäļ®┤ ņ╣©ņ░®ļ¼╝(keratic precipitate)Ļ│╝ Ļ░üļ¦ēļČĆņóģņØ┤ ļÅÖļ░śļÉśļ®┤ ļé┤Ēö╝ņŚ╝Ļ│╝ ļ╣äņŖĘĒĢ£ ņ¢æņāüņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśņ¢┤ ļŗ©ņł£Ēżņ¦äĻ░üļ¦ēņŚ╝ņ£╝ļĪ£ ņśżņ¦äĒĢĀ ņłś ņ׳ļŗż(Fig. 4) [6]. ņĢłļé┤ ņŚ╝ņ”ØņØ┤ ņ¦äĒ¢ēļÉśļŖö Ļ▓ĮņÜ░, ĒÖŹņ▒äņŚÉļÅä ņśüĒ¢źņØä ņŻ╝ņ¢┤ ĒÖŹņ▒äņ£äņČĢņØ┤ ņ¦äĒ¢ēļÉśļŖö Ļ▓ĮņÜ░ļÅä ņ׳Ļ│Ā(Fig. 5), ņØ┤ņ░© ļģ╣ļé┤ņןņØ┤ ļ░£ļ│æĒĢśļŖö Ļ▓ĮņÜ░ļÅä ņ׳ļŗż. Ļ░Ćņŗ£ņĢäļ®öļ░öĻ░Ć Ļ░üļ¦ē ņŻ╝ļ│ĆļČĆļĪ£ ņØ┤ļÅÖĒĢśņŚ¼ Ļ│Ąļ¦ēņØä ņ╣©ļ▓öĒĢśļ®┤ Ļ│Ąļ¦ēņŚ╝ņØ┤ ļéśĒāĆļéśĻĖ░ļÅä ĒĢ£ļŗż.
Ļ░Ćņŗ£ņĢäļ®öļ░ö Ļ░üļ¦ēņŚ╝ņØś ņ¦äļŗ©ņØĆ ņŚ╝ņāē, ļ░░ņ¢æ, ņĪ░ņ¦üĻ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ Ļ░Ćņŗ£ņĢäļ®öļ░ö ņśüņ¢æĒśĢ(trophozoites)ņØ┤ļéś ĒżļéŁ(cysts)ņØä ĒÖĢņØĖ ĒĢśļŖö Ļ▓āņØ┤ļéś, ĒśäņŗżņĀüņ£╝ļĪ£ ņé¼ņÜ®ĒĢśĻĖ░ ņ¢┤ļĀżņÜ┤ Ļ▓ĮņÜ░ļÅä ņ׳ņ¢┤ ĒŖ╣ņ¦ĢņĀüņØĖ ņ×äņāü ņåīĻ▓¼ņ£╝ļĪ£ ņ¦äļŗ©ĒĢśņŚ¼ ņ╣śļŻīĒĢśļŖö Ļ▓āņØ┤ ļÅäņøĆņØ┤ ļÉ£ļŗż. ņ¦äļŗ©ņØś gold standardļŖö ņāüĒö╝ ņåÉņāüņØ┤ ņŗ¼ĒĢ£ ļČĆņ£äņØś Ļ░üļ¦ē ņāüĒö╝ļź╝ ĻĖüņ¢┤ ļ░░ņ¦ĆņŚÉ ņĀæņóģĒĢśņŚ¼ ļ░░ņ¢æĒĢśļŖö Ļ▓āņØ┤ļ®░, ļ░░ņ¦ĆļŖö ļīĆņןĻĘĀņØ┤ ļÅäĒżļÉ£ ļ╣äņśüņ¢æĒśĢ ļ░░ņ¦Ć Escherichia coli (E. coli)-seeded non-nutrient agar plateļź╝ ņé¼ņÜ®ĒĢśņŚ¼ Ļ░Ćņŗ£ņĢäļ®öļ░öĻ░Ć E. coliļź╝ ĒżņŗØĒĢśĻ│Ā ņØ┤ļÅÖĒĢ£ ĻĖĖņØä ĒÖĢņØĖĒĢśļŖö Ļ▓āņ£╝ļĪ£, Ļ▓ĆņČ£ļźĀņØĆ 60-76% ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[5]. ļ░░ņ¢æņ£╝ļĪ£ Ļ░Ćņŗ£ņĢäļ®öļ░öļź╝ Ļ▓ĆņČ£ĒĢśļĀżļ®┤ 1-2ņŻ╝Ļ░Ć Ļ▒Ėļ”┤ ņłś ņ׳ņ¢┤, Haematoxylin and Eosin, Gram, Giemsa, methenamine silver, periodic acid-Schiff, calcofluor white, acridine orange ļō▒ ņŚ¼ļ¤¼ ņŚ╝ņāēļ▓ĢņØä ņØ┤ņÜ®ĒĢ£ ņŖ¼ļØ╝ņØ┤ļō£ Ļ┤Ćņ░░ņØ┤ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ļŗż.
ļÅÖņØ╝ņ┤łņĀÉĒśäļ»ĖĻ▓Į(confocal microscopy)ņØĆ ļ╣Āļź┤Ļ│Ā, ļ╣äņ╣©ņŖĄņĀüņ£╝ļĪ£ Ļ░Ćņŗ£ņĢäļ®öļ░ö ĒżļéŁņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŖö ļ░®ļ▓Ģņ£╝ļĪ£ 90% ņØ┤ņāüņØś ļ»╝Ļ░ÉļÅäņÖĆ ĒŖ╣ņØ┤ļÅäļź╝ ļ│┤ņØĖļŗż[7,8]. ļÅÖņØ╝ņ┤łņĀÉĒśäļ»ĖĻ▓ĮņŚÉņä£ Ļ░Ćņŗ£ņĢäļ®öļ░ö ĒżļéŁņØĆ ņ¢┤ļæÉņÜ┤ Ļ│Āļ”¼ļ¬©ņ¢æņØś ļé┤ļ▓ĮĻ│╝ Ļ▓ĮĻ│äĻ░Ć ļÜ£ļĀĘĒĢ£ ļ░ØņØĆ ņÖĖļ▓Įņ£╝ļĪ£ ļæśļ¤¼ņŗĖņØĖ Ļ│Āļ░śņé¼ņØś ĒĢĄņØä Ļ░Ćņ¦ä ŌĆ£signet-ringŌĆØ ļ¬©ņ¢æņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśļŖö ņØ┤ņżæļ▓Į ĒżļéŁņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśļéś[9], ļŗżļźĖ ņŚ╝ņ”Ø ņäĖĒżņÖĆ ĻĄ¼ļ│äĒĢśĻĖ░ ņ¢┤ļĀżņÜ┤ Ļ▓ĮņÜ░ļÅä ņ׳ņ¢┤ ņŻ╝ņØśļź╝ ņÜöĒĢśļŖöļŹ░, ņĄ£ĻĘ╝ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ņŚ╝ņ”ØņäĖĒżļŖö ļČłĻĘ£ņ╣ÖĒĢ£ ĒāĆņøÉĒśĢņ£╝ļĪ£ ņÖĖļ▓ĮņØ┤ ņŚåļŖö ĒżļéŁĻ│╝ņØś Ļ░Éļ│äņĀÉņØä ņĀ£ņŗ£ĒĢśņśĆļŗż[7]. ĻĘĖ ņÖĖ ņżæĒĢ®ĒÜ©ņåīņŚ░ņćä ļ░śņØæ(polymerase chain reaction)ņØĆ 85-90%ņØś ļ»╝Ļ░ÉļÅä ļ░Å ĒŖ╣ņØ┤ļÅäļź╝ Ļ░Ćņ¦ĆļŖö Ļ▓Ćņé¼ļĪ£ ļ░░ņ¢æņØīņä▒ņØś Ļ▓ĮņÜ░ņŚÉļÅä ņ¢æņä▒ņØä ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░ļÅä ņ׳ņ¢┤ ņ£ĀņÜ®ĒĢśļéś, Ļ░£ņ▓┤ ņé¼ļ®Ė ĒøäņŚÉļÅä ņ¢æņä▒ņØä ļ│┤ņØ╝ ņłś ņ׳ņ¢┤ ņ¦łĒÖśņØś ĒÖ£ņä▒ļÅäļź╝ Ļ░Éļ│äĒĢĀ ņłśļŖö ņŚåļŖö ļŗ©ņĀÉņØ┤ ņ׳ļŗż[10]. ņ╣śļŻīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņ¦ĆņåŹļÉśĻ▒░ļéś ņ×¼ļ░£ļÉśļŖö Ļ▓ĮņÜ░ ņĪ░ņ¦üņāØĻ▓ĆņØä ĒåĄĒĢ£ Ēśäļ»ĖĻ▓ĮņĀü Ļ▓Ćņé¼ļź╝ Ļ│ĀļĀżĒĢ┤ ļ│╝ ņłś ņ׳ļŗż.
Ļ░Ćņŗ£ņĢäļ®öļ░öļŖö ĒÖ£ļ░£ĒĢśĻ▓ī ņ”ØņŗØĒĢśļŖö ņśüņ¢æĒśĢ(trophozoites)Ļ│╝ Ē£┤ļ®┤ ņāüĒā£ņØĖ ĒżļéŁ(cyst)ņØś ļæÉ Ļ░Ćņ¦Ć ĒśĢĒā£ļĪ£ ņĪ┤ņ×¼ĒĢśĻ│Ā, ĒżļéŁ ņŗ£ĻĖ░ņŚÉ ņØ┤ņżæņØś ĒżļéŁļ▓Įņ£╝ļĪ£ ļæśļ¤¼ņŗĖņŚ¼ ņ׳ņ¢┤ ņśżļ×½ļÅÖņĢł ņāØņĪ┤ĒĢĀ ņłś ņ׳ņ¢┤ ĒżļéŁņØä ļ░Ģļ®ĖĒĢśļŖö ļŹ░ ņ╣śļŻī ĻĖ░Ļ░äņØ┤ ĻĖĖņ¢┤ņ¦ł ņłś ņ׳ļŗż[14]. Ēśäņ×¼Ļ╣īņ¦Ć Ļ░Ćņŗ£ņĢäļ®öļ░ö ņśüņ¢æĒśĢĻ│╝ ĒżļéŁĒśĢ ļ¬©ļæÉļź╝ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņé¼ļ®Ėņŗ£Ēé©ļŗżĻ│Ā ņĢīļĀżņ¦ä Ļ▓āņØĆ ņåīļÅģņĀ£ļĪ£ļÅä ņō░ņØ┤ļŖö ļ░öņØ┤ĻĄ¼ņĢäļŗłļō£(biguanide) Ļ│äņŚ┤ņØś ņĢĮļ¼╝ņØĖ 0.02% polyhexamethylene biguanide (PHMB)ņÖĆ 0.02% chlorhexidine digluconateĻ░Ć ņ׳ņ£╝ļ®░, PHMBņÖĆ chlorhexidine ļæÉ ņĢĮņĀ£ņØś ļŗ©ļÅģ ņ╣śļŻīļź╝ ļ╣äĻĄÉĒĢ£ randomized controlled trialņŚÉņä£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż[15]. Lee et al [16]ņØś ņØ┤ļōż ļæÉ ņĢĮņĀ£ņØś ļåŹļÅäņÖĆ ļģĖņČ£ņŗ£Ļ░äņŚÉ ļö░ļźĖ Ļ░üļ¦ē ĻĖ░ņ¦łņäĖĒż(keratocyte)ņØś ņäĖĒżņé¼ļź╝ ĒÖĢņØĖĒĢ£ ņŗżĒŚśņŗż ņŚ░ĻĄ¼ņŚÉņä£ PHMBĻ░Ć ļŹö ļÅģņä▒ņØ┤ ņ׳ļŖö Ļ▓āņØä ĒÖĢņØĖĒĢ£ ļ░ö ņ׳ļŗż. ļśÉĒĢ£ ņØ┤ļōż ņĢĮļ¼╝ņØä ņןĻĖ░Ļ░ä ņé¼ņÜ® ņŗ£ ņ╣śļŻī Ļ│╝ņĀĢņŚÉņä£ ļÅģņä▒ Ļ░üĻ▓░ļ¦ēņŚ╝ņØ┤ ņāØĻĖĖ ņłś ņ׳ņ¢┤, ņØ┤ņÖĆ Ļ┤ĆļĀ©ļÉ£ ņČ®ĒśłņØä ņŚ╝ļæÉņŚÉ ļæÉĻ│Ā ĒÖśņ×ÉņŚÉĻ▓ī Ļ░ĆļŖźņä▒ņØä ņäżļ¬ģĒĢĀ ņłś ņ׳ļŗż. ļīĆļČĆļČä ņ×äņāüņŚÉņä£ ņŚ¼ļ¤¼ ņĢĮņĀ£ļź╝ ļ│ĄĒĢ®ņĀüņ£╝ļĪ£ ņé¼ņÜ®ĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äņ£╝ļéś, ļ│ĄĒĢ® ņ╣śļŻīĻ░Ć ļŗ©ļÅģ ņ╣śļŻīņŚÉ ļ╣äĒĢ┤ ĒÜ©Ļ│╝ņĀüņØ┤ļØ╝ļŖö ĻĘ╝Ļ▒░ļŖö ņŚåļŖö ņŗżņĀĢņØ┤ļŗż. ĒĢ£ ņŗżĒŚśņŗż ņŚ░ĻĄ¼ņŚÉņä£, 1% voriconazoleņØ┤ Ļ░Ćņŗ£ņĢäļ®öļ░ö ņśüņ¢æĒśĢĻ│╝ ĒżļéŁĒśĢņØś ņé¼ļ®ĖņŚÉ 1ņ░© ņ╣śļŻīņĀ£ļĪ£ ņĢīļĀżņ¦ä chlorhexidineĻ│╝ ņ£Āņé¼ĒĢ£ ņĀĢļÅäļĪ£ ĒÜ©Ļ│╝Ļ░Ć ņ׳ņ£╝ļ®░, ņäĖĒżļÅģņä▒ņØĆ ņĀüļŗżĻ│Ā ĒĢśņśĆĻ│Ā, 5% moxifloxacinļÅä ĒżļéŁ ĒśĢņä▒ ņśłļ░®ĒÜ©Ļ│╝Ļ░Ć ņ׳ņ¢┤, Ļ░Ćņŗ£ņĢäļ®öļ░ö Ļ░üļ¦ēņŚ╝ ņŚÉņä£ ļ│ĄĒĢ® ņ╣śļŻīņĀ£ļĪ£ Ļ│ĀļĀżĒĢĀ ņłś ņ׳ļŗż[17]. Ļ▓ĮĻĄ¼ voriconazoleļÅä ņ╣śļŻīņŚÉ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ņ¢┤ ņ╣śļŻī ļ░śņØæņØ┤ ņĀüņØĆ ĒÖśņ×ÉņŚÉĻ▓ī ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŗż[18]. ĻĖ░ņĪ┤ ņĢĮņĀ£ļōżņØ┤ ņןĻĖ░ ņé¼ņÜ®ņØ┤ ĒĢäņÜöĒĢśļéś ņĢłĻĄ¼ ļÅģņä▒ņØ┤ ņ׳ļŖö ņĀÉņØä Ļ│ĀļĀżĒĢśņŚ¼, 2016ļģä ļ»ĖĻĄŁ Food and Drug AdministrationņØ┤ ĻĖ░ņĪ┤ņŚÉ ļ”¼ņŖłļ¦īĒÄĖļ¬©ņČ®ņ”Ø ņ╣śļŻīņĀ£ļĪ£ ņé¼ņÜ®ļÉśļŹś Ļ▓ĮĻĄ¼ miltefosine (hexadecylphosphocholine; Impavido, Profounda, Inc.)ņØä Ļ░Ćņŗ£ņĢäļ®öļ░ö ņ╣śļŻīļź╝ ņ£äĒĢ£ ĒؼĻĘĆņØśņĢĮĒÆłņ£╝ļĪ£ ņØĖņĀĢĒĢ£ Ēøä ņØ┤ņØś ļ│┤ņĪ░ņĀü ņ╣śļŻīņØś ĒÜ©Ļ│╝ļź╝ ļ│┤Ļ│ĀĒĢ£ ņŚ░ĻĄ¼ļōżņØ┤ ņ׳Ļ│Ā[19,20], Ļ▓ĮĻĄ¼ņĢĮņĀ£ņØś ņ£äņןņןņĢĀ, Ļ░äļÅģņä▒, ņŗĀļÅģņä▒ņØä Ļ│ĀļĀżĒĢśņŚ¼ ņĄ£ĻĘ╝ņŚÉ ņĀÉņĢłņĀ£ļĪ£ Ēł¼ņŚ¼ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ņŗ¼ĒĢ£ Ļ░Ćņŗ£ņĢäļ®öļ░ö Ļ░üļ¦ēņŚ╝ņŚÉņä£ miltefosine ņĀÉņĢłņĢĪ ļŗ©ļÅģ ņ╣śļŻīļŖö ĒÜ©Ļ│╝Ļ░Ć ņŚåļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņ¢┤ ņČöĻ░ĆņĀü ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢ£ ņāüĒā£ņØ┤ļŗż[21,22].
Ļ░Ćņŗ£ņĢäļ®öļ░öļŖö Pseudomonas aeruginosa, Fusarium spp. Ļ░ÖņØĆ ļŗżļźĖ ļ│æņøÉĻĘĀņØä ņäĖĒż ļé┤ ņÜ┤ļ░śĒĢśņŚ¼ ņäĖĻĘĀņØ┤ļéś ņ¦äĻĘĀņØś ņżæļ│ĄĻ░ÉņŚ╝ņØ┤ ļ│┤Ļ│ĀļÉśĻĖ░ļÅä ĒĢśņŚ¼, ņ╣śļŻīņŚÉ ļ░śņØæņØ┤ ņĀüņØä ļĢī ņżæļ│ĄĻ░ÉņŚ╝ņØä Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗż.
Ļ░Ćņŗ£ņĢäļ®öļ░ö Ļ░üļ¦ēņŚ╝ņŚÉņä£ ņŗ¼ĒĢ£ ņŚ╝ņ”ØņØä ļÅÖļ░śĒĢśņŚ¼ ĒĢŁņĢäļ®öļ░ö ņĢĮļ¼╝Ļ│╝ ļŹöļČłņ¢┤ ņŖżĒģīļĪ£ņØ┤ļō£Ļ░Ć ņé¼ņÜ®ļÉśĻĖ░ļÅä ĒĢ£ļŗż. ĒĢśņ¦Ćļ¦ī ĒĢŁņĢäļ®öļ░öņĢĮļ¼╝ ņŗ£ņ×æ ņĀä ņŖżĒģīļĪ£ņØ┤ļō£ņØś ņé¼ņÜ®ņØĆ ņ¦äļŗ© ņ¦ĆņŚ░, ņĄ£ņóģ ņŗ£ļĀźņĀĆĒĢś, Ļ░üļ¦ēņØ┤ņŗØņØ┤ ĒĢäņÜöĒĢ£ ņŗ¼ĒĢ£ ļŗ©Ļ│äļĪ£ ņ¦äĒ¢ēĒĢśļŖö ļéśņü£ ņśłĒøäņŚÉ ņ£ĀņØśĒĢ£ ņśüĒ¢źņØä ņżä ņłś ņ׳ņ¢┤[4,23], Ļ░Ćņŗ£ņĢäļ®öļ░ö ņ¦äļŗ©ņØ┤ ņØśņŗ¼ļÉĀ Ļ▓ĮņÜ░ņŚÉļŖö ņŖżĒģīļĪ£ņØ┤ļō£ ņé¼ņÜ®ņØĆ ĒĢŁņĢäļ®öļ░ö ņĢĮļ¼╝ņØ┤ ņŗ£ņ×æļÉ£ Ēøä, Ļ░ÉņŚ╝ ņ¦ĢĒøäĻ░Ć ņĪ░ņĀłļÉśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśļ®░ ņé¼ņÜ®ĒĢśļŖö Ļ▓āņØ┤ ĻČīņןļÉ£ļŗż.
Ļ░Ćņŗ£ņĢäļ®öļ░ö ņ╣śļŻīļŖö ņĢĮļ¼╝ ņ╣śļŻīĻ░Ć ņØ╝ņ░©ņĀüņ£╝ļĪ£ ņŗ£ļÅäļÉśņ¦Ćļ¦ī, Ļ░ÉņŚ╝ņØ┤ ņĪ░ņĀłļÉśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░, Ļ░üļ¦ē Ēś╝Ēāüņ£╝ļĪ£ ņŗ£ļĀźņĀĆĒĢśĻ░Ć ņ׳ļŖö Ļ▓ĮņÜ░ Ļ░üļ¦ēņØ┤ņŗØņØä ņŗ£Ē¢ēĒĢ£ļŗż. Ļ░üļ¦ēĻĄÉņ░©Ļ▓░ĒĢ®ņłĀĻ│╝ ļāēļÅÖ ņ╣śļŻīļÅä ļ│┤ņĪ░ņĀü ņ╣śļŻīņĀü ļ░®ļ▓Ģņ£╝ļĪ£ ņŗ£ļÅäļÉśĻĖ░ļÅä ĒĢśņśĆņ£╝ļéś, ĒÜ©Ļ│╝Ļ░Ć ņĀ£ĒĢ£ņĀüņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[24,25].
ņĄ£ĻĘ╝ Ļ░Ćņŗ£ņĢäļ®öļ░ö Ļ░üļ¦ēņŚ╝ 194ņĢłņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ĒĢ┤ņÖĖ ļ│┤Ļ│ĀņŚÉņä£ Ļ│Āļ”¼ļ¬©ņ¢æņ╣©ņ£żņØ┤ļéś Ļ│Ąļ¦ēņŚ╝ņØä ļÅÖļ░śĒĢ£ ņŗ¼ĒĢ£ ņŚ╝ņ”Ø, ĒĢŁņĢäļ®öļ░ö ņ╣śļŻī ņĀä ņŖżĒģīļĪ£ņØ┤ļō£ Ēł¼ņŚ¼, ņ¦äļŗ© ņĀä ņ”Øņāü ĻĖ░Ļ░ä(37ņØ╝ ņ┤łĻ│╝), 34ņäĖ ņØ┤ņāü ņŚ░ļĀ╣ņØ┤ ļéśņü£ ņśłĒøäņÖĆ Ļ┤ĆļĀ©ņØ┤ ņ׳Ļ│Ā, ĒĢŁņĢäļ®öļ░ö ņ╣śļŻī ņĀä ņŖżĒģīļĪ£ņØ┤ļō£ ņé¼ņÜ®Ļ│╝ ĒŚżļź┤ĒÄśņŖż Ļ░üļ¦ēņŚ╝ ņ╣śļŻīļĀźņØ┤ ņŗ¼ĒĢ£ ņŚ╝ņ”ØĻ│╝ Ļ┤ĆļĀ©ļÉśņŚłļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[26]. ļśÉĒĢ£ ņ¦äļŗ© ņŗ£ ņāüĒö╝ ļ│æļ│ĆĻ│╝ ļ░®ņé¼Ļ░üļ¦ēņŗĀĻ▓ĮņŚ╝ļ¦ī Ļ┤Ćņ░░ļÉ£ Ļ▓ĮņÜ░ņŚÉļŖö ņŗ£ļĀź ņśłĒøäĻ░Ć ņóŗļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ļŗż[27,28]. ļ╣äņĀäĒśĢņĀüņØĖ Ļ░üļ¦ē ļ│æļ│ĆņØ┤ Ļ┤Ćņ░░ļÉśļŖö ĒÖśņ×ÉņŚÉņä£ ņĮśĒāØĒŖĖļĀīņ”ł ņé¼ņÜ®ļĀźņØä ļ░śļō£ņŗ£ ĒÖĢņØĖĒĢśĻ│Ā, ņØśņŗ¼ņØä ĒĢśņŚ¼ ļ╣ĀļźĖ ņ¦äļŗ©Ļ│╝ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśļŖö Ļ▓āņØ┤ ņśłĒøäņŚÉ ļ¼┤ņŚćļ│┤ļŗż ņżæņÜöĒĢśļŗż.
Ļ░Ćņŗ£ņĢäļ®öļ░ö Ļ░üļ¦ēņŚ╝ņØ┤ ļīĆļČĆļČä ņĮśĒāØĒŖĖļĀīņ”łņÖĆ Ļ┤ĆļĀ©ĒĢśņŚ¼ ļ░£ņāØĒĢśĻ│Ā, ņĄ£ĻĘ╝ ņåīņĢäņØś ĻĘ╝ņŗ£ ņĪ░ņĀłņØä ņ£äĒĢ┤ ņé¼ņÜ®ļ¤ēņØ┤ ņ”ØĻ░ĆĒĢśļ®┤ņä£ Ļ░üļ¦ēĻĄ┤ņĀłĻĄÉņĀĢļĀīņ”ł(orthokeratology lens)ņÖĆ Ļ┤ĆļĀ©ļÉ£ Ļ░Ćņŗ£ņĢäļ®öļ░ö Ļ░ÉņŚ╝ļÅä ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[29,30]. ņĮśĒāØĒŖĖļĀīņ”ł ņé¼ņÜ®ņ×Éļéś ļ│┤ĒśĖņ×ÉļōżņŚÉĻ▓ī ļ│┤Ļ┤ĆņÜ®ĻĖ░ļź╝ ņ▓ĀņĀĆĒ׳ ņåīļÅģĒĢśĻ│Ā, ņśżņŚ╝ļÉ£ ļ¼╝ņŚÉ ņĀæņ┤ē, ņłśļÅŚļ¼╝ņŚÉ ņĀæņ┤ēĒĢśņ¦Ć ņĢŖļŖö ļō▒ ņ£äņāØņŚÉ ļīĆĒĢ£ ĻĄÉņ£ĪņØä ĒĢśļŖö Ļ▓āņØ┤ Ļ░Ćņŗ£ņĢäļ®öļ░ö Ļ░üļ¦ēņŚ╝ņØä ņśłļ░®ĒĢśļŖö ļŹ░ ņżæņÜöĒĢśĻ▓Āļŗż[3,31]. ļśÉĒĢ£ Ļ░Ćņŗ£ņĢäļ®öļ░ö Ļ░üļ¦ēņŚ╝ Ēøä Ļ░üļ¦ē Ēś╝Ēāüņ£╝ļĪ£ ņŗ£ļĀźĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņéČņØś ņ¦łņØ┤ ņĀĆĒĢśļÉĀ ņłś ņ׳ņ¢┤[32], Ļ░üļ¦ē Ēś╝ĒāüņØ┤ ņāØĻ▓╝ņØä ļĢī Ļ░ĆņŖżĒł¼Ļ│╝Ļ▓Įņä▒ņĮśĒāØĒŖĖļĀīņ”ł(rigid gas permeable contact lens)ļéś Ļ│Ąļ¦ēļĀīņ”ł ļō▒ņØä ņØ┤ņÜ®ĒĢ£ ņŗ£ļĀź ņ×¼ĒÖ£ņØä ņ£äĒĢ£ ļģĖļĀź ļ░Å ņ¦Ćņ¦ĆļÅä ņżæņÜöĒĢśļŗż.
Figure┬Ā3.
Slit-lamp photographs of progression and healing of ring infiltration during the 5-month treatment.

REFERENCES
1) Schuster FL, Visvesvara GS. Free-living amoebae as opportunistic and non-opportunistic pathogens of humans and animals. Int J Parasitol 2004;34:1001-27.


2) Bonini S, Di Zazzo A, Varacalli G, Coassin M. Acanthamoeba keratitis: perspectives for patients. Curr Eye Res 2021;46:771-6.


3) Carnt N, Stapleton F. Strategies for the prevention of contact lens-related Acanthamoeba keratitis: a review. Ophthalmic Physiol Opt 2016;36:77-92.


4) Robaei D, Carnt N, Minassian DC, Dart JK. The impact of topical corticosteroid use before diagnosis on the outcome of Acanthamoeba keratitis. Ophthalmology 2014;121:1383-8.


5) Dart JK, Saw VP, Kilvington S. Acanthamoeba keratitis: diagnosis and treatment update 2009. Am J Ophthalmol 2009;148:487-99.e2.


6) Lakhani BK, Thajudeen B, Jawaid I, et al. Endotheliitis-A presentation of Acanthamoeba keratitis. Cornea 2021;40:769-73.


7) Li S, Bian J, Wang Y, et al. Clinical features and serial changes of Acanthamoeba keratitis: an in vivo confocal microscopy study. Eye (Lond) 2020;34:327-34.




8) Dua HS, Aralikatti A, Said DG. Rapid diagnosis of Acanthamoeba keratitis. Br J Ophthalmol 2009;93:1555-6.


9) Alomar T, Matthew M, Donald F, et al. In vivo confocal microscopy in the diagnosis and management of acanthamoeba keratitis showing new cystic forms. Clin Exp Ophthalmol 2009;37:737-9.


10) Lehmann OJ, Green SM, Morlet N, et al. Polymerase chain reaction analysis of corneal epithelial and tear samples in the diagnosis of Acanthamoeba keratitis. Invest Ophthalmol Vis Sci 1998;39:1261-5.

11) Agarwal M, Asokan R, Therese KL, Lakshmipathy M. Bilateral Acanthamoeba keratitis with radial keratoneuritis - utility of AS-OCT in management and treatment. Clin Exp Optom 2021;104:871-3.


12) Lee PY, Lin CC, Chiu LY, Lee PY. Bilateral radial keratoneuritis resulting from acanthamoeba keratitis. Kaohsiung J Med Sci 2022;38:79-80.



13) Yamazaki N, Kobayashi A, Yokogawa H, et al. In vivo imaging of radial keratoneuritis in patients with Acanthamoeba keratitis by anterior-segment optical coherence tomography. Ophthalmology 2014;121:2153-8.


14) Clarke DW, Niederkorn JY. The pathophysiology of Acanthamoeba keratitis. Trends Parasitol 2006;22:175-80.


15) Lim N, Goh D, Bunce C, et al. Comparison of polyhexamethylene biguanide and chlorhexidine as monotherapy agents in the treatment of Acanthamoeba keratitis. Am J Ophthalmol 2008;145:130-5.


16) Lee JE, Oum BS, Choi HY, et al. Cysticidal effect on acanthamoeba and toxicity on human keratocytes by polyhexamethylene biguanide and chlorhexidine. Cornea 2007;26:736-41.


17) Mart├Łn-Navarro CM, L├│pez-Arencibia A, Arnalich-Montiel F, et al. Evaluation of the in vitro activity of commercially available moxifloxacin and voriconazole eye-drops against clinical strains of Acanthamoeba. Graefes Arch Clin Exp Ophthalmol 2013;251:2111-7.



18) Tu EY, Joslin CE, Shoff ME. Successful treatment of chronic stromal acanthamoeba keratitis with oral voriconazole monotherapy. Cornea 2010;29:1066-8.



19) Naranjo A, Martinez JD, Miller D, et al. Systemic miltefosine as an adjunct treatment of progressive Acanthamoeba keratitis. Ocul Immunol Inflamm 2021;29:1576-84.


20) Avdagic E, Chew HF, Veldman P, et al. Resolution of Acanthamoeba keratitis with adjunctive use of oral miltefosine. Ocul Immunol Inflamm 2021;29:278-81.


21) Polat ZA, Obwaller A, Vural A, Walochnik J. Efficacy of miltefosine for topical treatment of Acanthamoeba keratitis in Syrian hamsters. Parasitol Res 2012;110:515-20.



22) Bagga B, Joseph J, Garg P, et al. Efficacy of topical miltefosine in patients with Acanthamoeba keratitis: a pilot study. Ophthalmology 2019;126:768-70.


23) Wouters KA, Verhoekx JS, van Rooij J, et al. Topical corticosteroids in Acanthamoeba keratitis: friend or foe? Eur J Ophthalmol 2022;32:170-5.



24) Berra M, Galper├Łn G, Boscaro G, et al. Treatment of Acanthamoeba keratitis by corneal cross-linking. Cornea 2013;32:174-8.


25) Hager T, Hasenfus A, Stachon T, et al. Crosslinking and corneal cryotherapy in acanthamoeba keratitis -- a histological study. Graefes Arch Clin Exp Ophthalmol 2016;254:149-53.



26) Carnt N, Robaei D, Minassian DC, Dart JKG. Acanthamoeba keratitis in 194 patients: risk factors for bad outcomes and severe inflammatory complications. Br J Ophthalmol 2018;102:1431-5.


27) Por YM, Mehta JS, Chua JL, et al. Acanthamoeba keratitis associated with contact lens wear in Singapore. Am J Ophthalmol 2009;148:7-12.e2.


28) Tu EY, Joslin CE, Sugar J, et al. Prognostic factors affecting visual outcome in Acanthamoeba keratitis. Ophthalmology 2008;115:1998-2003.



29) Hsu CC, Kuo YS, Lin PY, Chen KH. Overnight orthokeratology-associated Acanthamoeba keratitis at a tertiary referral hospital in Taiwan: a retrospective case-control study. J Chin Med Assoc 2022;85:381-7.


30) Scanzera AC, Tu EY, Joslin CE. Acanthamoeba Keratitis in minors with orthokeratology (OK) lens use: a case series. Eye Contact Lens 2021;47:71-3.



-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,414 View
- 41 Download
- Related articles
-
Update on Diagnosis and Treatment of Retinopathy of Prematurity2018 December;17(4)
Diagnosis and Management of Orbital Wall Fracture2016 December;15(4)
Diagnosis and Management of Meibomian Gland Dysfunction2016 June;15(2)
Diagnosis and Treatment of Contact Lens?Related Dry Eye2015 March;14(1)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print