망막색소변성 환자의 시기능과 기능적 시력
Visual Function and Functional Vision of Retinitis Pigmentosa
Article information
Abstract
망막색소변성 환자는 시야결손, 색각이상, 대비감도 감소, 읽기와 운전장애 등 다양한 시각 이상과 기능적 시각 이상을 나타낸다. 망막색소변성 환자에 대한 시기능 이해는 치료 효과를 판정하는 임상시험에서 필수적으로 고려되어야 한다. 또한 시각장애 판정 등에서 망막변성 환자가 불이익을 당하지 않도록 도와줄 수 있을 것이다.
Trans Abstract
Patients with retinitis pigmentosa have defects in visual function, including the visual field, color vision, contrast sensitivity, and impaired functional vision, such as reading and driving. An assessment of visual function is required when interpreting the outcome of clinical trials of retinitis pigmentosa. Various defects of functional vision should be considered when assessing visual impairment for patients with retinitis pigmentosa.
서 론
망막색소변성은 광범위한 광수용체세포 소실과 망막기능장애가 특징이며, 지속적으로 진행하여 실명까지 나타나게 되는 유전성 망막변성질환을 말한다. 망막색소변성(retinitis pigmentosa, RP)은 수천 명에 한 명 꼴로 발생하는 대표적인 망막변성질환으로써 광범위한 광수용체세포의 이상과 야맹증, 시야장애를 특징으로 한다. 현재까지 80개 이상의 유전자에서 원인 유전변이가 발견되었고 최근 유전자검사법의 발전으로 원인 유전변이의 수가 점점 더 증가하고 있다[1]. 양안 실명의 가장 중요한 원인질환으로서 최근 유전자치료와 줄기세포치료 등에 대한 연구가 활발하게 진행되고 있다.
망막색소변성은 원인 유전자에 따라서 병의 시작과 진행, 예후가 다르기 때문에 하나의 질환이 아니라 질환군이라고 할 수 있다. 또한 동일한 유전자의 이상으로 발생한 경우에도 돌연변이의 위치에 따라서 해부병리학적인 차이가 있을 수 있다. 따라서 시기능 이상을 정확하게 모니터링하는 것이 중요하다. 시기능(visual function)은 시력, 시야, 색각 뿐만 아니라 독서 속도와 독해력, 운전 등 기능적 시력(functional vision)을 포함한다.
일반적으로 망막색소변성으로 인한 변성은 망막주변부에서 시작하기 때문에 야맹증과 시야결손이 심한 경우에도 황반 합병증이 없으면 중심시력이 1.0 (20/20) 근처일 수 있다. 이러한 경우 중심시력만으로 망막색소변성 환자의 시기능을 평가하기는 불가능하다. 시력이 정상에 가깝기 때문에 다른 시기능 또한 나쁘지 않을 것이라고 오해를 받을 수도 있다. 그러나 중심시력이 정상 범위에 속한 망막색소변성 환자들에서도 시야장애, 대조감도 감소, 독서 속도, 암순응장애 등 광범위한 시기능 손상이 발생한다. 실제 일상생활에서 시각과 연관된 기능의 손상 정도를 표시하는 기능적 시각(functional vision)이 RP 환자에서 크게 감소한다고 알려져 있다[1]. 따라서 망막색소변성 환자의 시기능을 평가하기 위해서는 중심시력뿐만 아니라 여러 가지 방법으로 시기능을 평가하고 종합적으로 판단하여야 한다.
시 력
시력은 시기능을 대표하는 지표로서 임상과 연구 모두에서 가장 중요한 시기능 측정 방법이다. 시력은 시각적인 분해능을 말하며 최소분해각(the minimal angle of resolution, MAR)의 역수로 표시한다. 즉, 최소분해각이 작을수록 시력이 좋다고 할 수 있는데, 최소분해각이 1°와 2°인 경우 시력(스넬렌시력)은 각각 1.0, 0.5에 해당한다. 로그마(logMAR)는 최소분해각의 로그로 계산하는데, 1.0 스넬렌시력의 logMAR는 0 (log1)이고 0.5 시력의 logMAR (log2)는 0.3이 된다. 따라서 최소분해각(MAR)이 두 배로 증가하거나 감소할 때 logMAR는 0.3 unit 증가하거나 감소한다. 임상연구에서 표준 시력검사 방법으로 사용하는 ETDRS 글자 시력표는 세 줄(15글자)마다 분해각이 두 배가 되기 때문에, 한 줄(5글자)은 0.1 logMAR unit, 1 글자는 0.02 logMAR unit에 각각 해당한다. 일반적으로 두 줄(10글자, 0.2 logMAR unit) 이상 시력이 향상되거나 악화될 때 유의한 차이가 있다고 정의한다(Fig. 1).
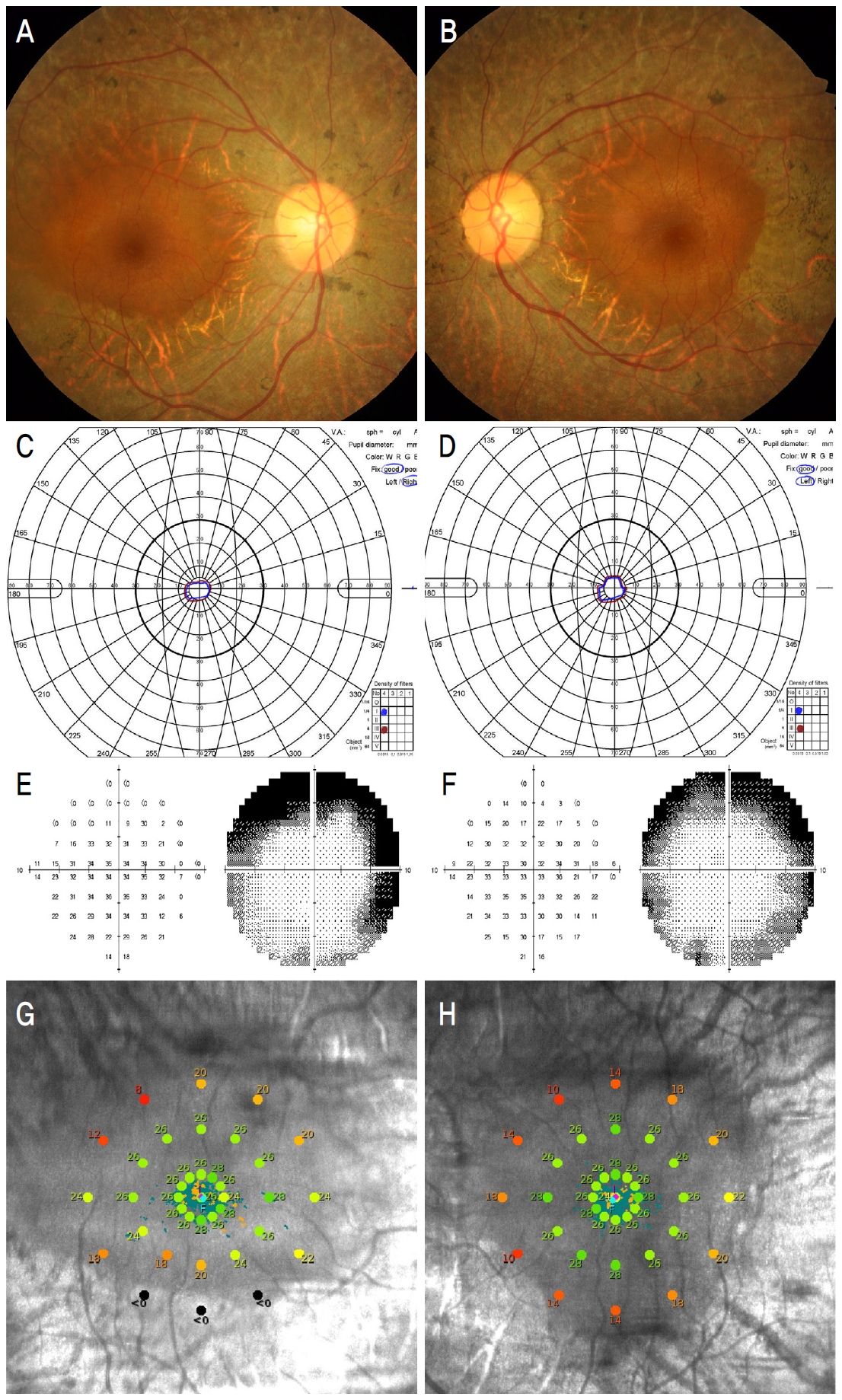
Representative fundus photograph and visual function test results of a patient having retinitis pigmentosa. Left column is right eye and right column is left eye of a same patient (A, B) Fundus photograph. Retinal pigmentary degeneration including bony spicule formation is observed except for the central macular area (C, D) Goldman kinetic perimetry. (E, F) Humphrey static perimetry 10-2. Visual field is constricted to 10 degrees around fixation point. (G, H) Macular integrity assessment (MAIA) microperimetry. Retinal sensitivity is presented at corresponding retinal location with color scale in scanning laser ophthalmoscope image. The decibel scale is color coded according to the MAIA normative studies where ‘green’ represent normal value, “yellow’ suspect, ‘red’ abnormal and ‘black’ represent scotomas. Retinal sensitivity is normal range within central macula while it decreased at degenerated region.
시력검사가 망막색소변성 환자의 시기능을 잘 나타내지 못하는 경우가 흔하다. 열성유전을 하는 망막색소변성 환자에 대한 연구에서 황반부 병변이 없을 때는 75% 환자에서 20/40 이상의 좋은 시력을 보였고, 황반부 병변이 있을 때는 반대로 20/70 이하의 나쁜 시력이 44%에서 관찰되어, 황반중심부 병변의 유무가 시력과 밀접한 관계가 있었다[2]. 시력은 황반중심부에 있는 광수용체의 기능과 관계가 있어서, 중심와 광수용체가 온전하면 정상시력을 나타내고 손상되면 시력이 감소한다. 반대로 주변 망막변성이 광범위하게 발생해서 황반 주변부까지 시야협착이 심한 경우에도 중심와 광수용체가 비교적 온전하면 정상에 가까운 시력을 보일 수 있다. 따라서 중심시력만으로 망막색소변성 환자의 시기능을 판단해서는 안된다.
어두운 곳에서 시력측정을 하는 경우 망막색소변성 환자에서 더 나쁘게 측정된다. 보통 시력은 밝은 환경에서 대조가 분명한 시력표를 이용하여 측정한다. 어두운 곳에서 측정한 시력은 밝은 환경에서 측정한 시력보다 일반적으로 낮게 측정되는데, 망막색소변성과 같은 망막변성 환자는 시기능이 떨어질수록 그 차이가 더 크게 나타난다. 시력검 사실이 어둡고 시력검사표의 휘도(luminance)가 낮을 때 정상인과 비교하여 더 잘 보지 못하기 때문이다. 따라서 망막변성 환자에서 어두운 곳에서 측정한 저휘도시력(low-luminance visual acuity)이 시기능의 손상을 더 민감하게 반영한다고 말할 수 있다. 황반변성 환자와 건강 대조군을 비교한 12개월 전향적 추적 관찰 연구에서 일반적으로 측정한 시력은 두 군 모두 비슷하게 유지되었지만 저휘도시력은 황반변성 환자에서 의미 있는 감소를 나타냈다[3]. 이러한 결과는 망막변성 환자에서 어두운 곳에서 측정한 저휘도시력이 치료 효과를 비교하는 임상시험에서 시기능을 모니터링하는 지표로서 유용하게 사용될 수 있다는 것을 보여준다[4].
시야결손(동적시야)
망막색소변성의 시야결손은 주변시야가 좁아지면서 시야가 감소하는 것이 특징이다. 황반 합병증이 없으면 중심 시야는 상대적으로 나중까지 유지될 수 있다. 한편 색소변성 환자에서 시야손상 정도는 시력감소와 관계가 있다. 이전 연구에서 시력과 시야(면적)를 모두 지수로 환산하여 계산하면 색소변성 환자의 시력과 시야는 매우 높은 양의 상관관계를 나타냈다[5].
임상에서 흔히 사용하는 스넬렌시력검사는 결과가 일정하지 않을 수 있기 때문에 시야검사가 이러한 오차를 보상하는 시기능의 중요한 지표로 사용되고 있다. 망막색소변성 환자의 시력은 밝기(조도, 휘도)에 따라서 차이가 크기 때문에 환경에 따른 오차 또한 다른 사람보다 크게 발생한다. 시야검사는 시력검사보다 재현성이 높고 일정한 환경에서 검사하기 때문에, 망막색소변성 환자의 시기능을 측정하는 좋은 방법이 될 수 있다. 따라서 망막변성 치료제 개발을 위한 임상시험에서도 시야검사가 중요한 평가 지표 중 하나로 이용되고 있다.
최근 발표된 장기간 관찰 연구에서 색소변성 환자의 시야결손 진행 속도를 분석하였다. 연구에 포함된 환자의 절반에서 운전이 어려운 시야결손이 37세까지 발견되었고, 절반에서 55세까지 법정 실명에 도달하였다. 같은 연구에서 시야 손실 속도가 유전양상에 따라서 다르게 나타났다. 시야 손실의 연평균 비율이 상염색체 열성에서는 10.3%, 우성에서는 2.7%, X-관련 유전에서는 7.2%로 차이가 있었는데, 서울대학교병원에 내원한 색소변성 환자를 대상으로 한 이전 우리 연구에서도 열성유전 환자에서 시야손상 정도가 더 심한 것으로 조사되었다[6]. 이러한 유전양상에 따른 시야결손의 차이는 변성에 대한 전향적인 임상시험에서 시야를 평가 지표로 할 때 고려되어야 한다.
망막변성 환자는 중심와주시를 잘 못하는 경우가 많아서 험프리 시야와 같은 정적 시야검사는 어렵기 때문에 골드만 시야와 같은 동적시야검사가 표준시야검사 방법으로 사용되어 왔다. 그러나 시야의 위축이 중심와에 근접한 경우에 동적 시야검사는 민감도가 떨어지는 반면에 중심부의 시야를 정밀하게 측정할 수 있는 험프리 시야검사의 10-2 프로토콜이 병의 진행 정도를 잘 보여줄 수 있다[7].
미세시야
미세시야검사가 나이관련황반변성 등 망막변성 환자에서 시기능 평가의 유용한 방법으로 점점 더 많이 사용되고 있다[8]. 미세시야검사는 일반적인 시야검사와 달리 눈의 움직임을 실시간으로 추적함으로써 눈의 움직임으로 인한 오차를 보상할 수 있다. 임상에서 흔하게 사용하는 험프리 시야(Humphrey visual field)는 정적 시야검사로서 중심외주시(eccentric fixation)가 있는 망막 환자에서 오차가 크게 나타난다. 따라서 미세시야는 망막색소변성과 황반변성 환자에서 정적 시야검사를 대체하는 유용한 시기능평가 방법이 될 수 있다.
황반인테그리티평가(the Macular Integrity Assessment, MAIA)는 상업적으로 이용되는 미세시야검사 중 하나로써 여러 강도의 자극을 사용함으로써 보다 정확한 검사가 가능하고, 재현성과 평가자 간 일치율이 높다고 알려져 있다. 따라서 중심 근부 암점(paracentral scotoma)의 평가와 모니터링 방법으로써 망막 환자 진료와 임상시험에서 사용이 증가하고 있다[9,10]. 미세시야는 황반부 각 지점의 민감도를 제공할 뿐만 아니라 주시 안정성(fixation stability)에 대한 지표를 제공한다. 주시 안정성은 일정 시간 동안 타겟을 주시하게 하고 그 정확도를 측정한다. 정상인에서는 안정성이 높아서 주시점이 한 점으로 모이지만 황반질환 환자에서는 주시 안정성이 낮아서 구름 모양으로 주시점이 흩어져서 분포한다.
황반변성과 망막색소변성 등 망막질환 환자에서 중심시력은 안정적으로 유지되고 있지만, 더 어둡게 보인다고 호소하는 경우를 종종 볼 수 있다. 미세시야는 시력 측정에서 나타나지 않는 망막 민감도 감소를 나타낼 수 있다. 당뇨망막병증 환자에서 황반부종이 있거나 경성삼출물이 있는 경우 미세시야에서 낮은 망막민감도를 보였다[11]. 망막색소변성 환자를 대상으로 한 연구에서도 시력은 안정적으로 유지되었지만 미세시야의 망막민감도는 지속적인 감소를 나타냈다[12]. 따라서 미세시야검사가 시력 측정보다 망막 이상으로 인한 시기능의 장애를 더 민감하게 반영한다고 할 수 있다(Fig. 2).

Macular integrity assessment (MAIA) microperimetry results of healthy person (A-G) and patient having retinitis pigmentosa (H-N). (A, H) Scanning laser ophthalmoscope (SLO) image. (B, I) Retinal sensitivity values (decibel) over zoomed SLO image. (C, J) Interpolated sensitivity map over full SLO image. (D, K) Color coded macular integrity index and average threshold. (E, L) Histogram of threshold vales (grey) compared with normal distribution (green). (F, M) Fixation plot over zoomed SLO image and preferred retinal locus identification. (G, N) Color coded fixation stability and fixation graph describing amplitude of eye movements versus time. In healthy person, all retinal sensitivity values are within normal ranges and color codes are all green. Macular integrity index and average threshold are normal. Histogram of threshold values are located within normal distribution. Fixation is stable and most of fixation plot are located within 1-2 degrees around foveola. In retinitis pigmentosa patient, retinal sensitivity over degenerated retina decreased abnormally. Both macular integrity index and average threshold are abnormal. Most of threshold values fall outside normal distribution. Fixation is stable and fixation plot tend to be located around foveola. However, bivariate contour ellipse area is relatively larger compared to that of healthy person.
요약하면 미세시야검사는 중심시력 측정에서 발견하기 어려운 망막 민감도 이상을 측정함으로써 환자 진료와 임상시험 연구 등에서 점점 더 널리 사용될 것으로 기대된다. 또한 MAIA 등 미세시야에서 제공하는 주시 안정성 지표도 망막 민감도 지표와 함께 망막 기능 이상을 조기에 발견하는 데 추가적인 도움을 줄 수 있다. 망막색소변성과 나이관련황반변성에 대한 임상시험에서는 어두운 곳에서 측정한 시력과 함께 미세시야가 시험약제의 치료 효과 판정에서 중요한 평가 지표 중 하나로서 이용되고 있다.
대비감도
병원에서 시행하는 정기적인 검사에서 중심 시력이 양호하게 나온 경우에도 실제 생활에서 보기가 더 어렵고 불편하다고 말하는 망막색소변성 환자들이 많다. 주관적으로 느끼는 시력의 감소와 스넬렌 시력표로 측정한 시력에 괴리가 발생하는 것이다. 대비감도는 변성 환자가 느끼는 시기능의 감소를 대변할 수 있다고 알려졌다. 유전자의 이상이 규명된 망막색소변성 환자를 대상으로 시력과 대비감도, 빛간섭단층촬영 등을 분석하였다. 시력이 비교적 좋은 환자에서도 심한 대비감도의 감소가 발견되었고 대비감도와 일상생활에서 느끼는 기능적 시기능 사이에 상관관계가 있었다[13,14]. 한편, 변성 환자의 대비감도 감소는 낮은 공간주파수(spatial frequency) 보다는 높은 공간주파수에서 차이가 더 뚜렷하였는데, 이러한 결과는 높은 공간주파수를 잘 측정하는 대비감도검사 방법이 변성 환자에서 유리하다는 것을 암시한다.
색각이상
색각이상은 시력감소, 시야협착과 함께 망막색소변성 환자의 주된 시기능 이상 중 하나이다. 망막색소변성 환자의 73%에서 후천적 색각이상이 발생하였고, 청색맹(trianopia), 녹색맹(deuteranopia), 적색맹(protanomaly) 등 다양한 형태로 나타난다[15]. 이 중 청색맹이 2/3로 가장 흔하다. 선천성 색각이상은 적록색맹이 흔해서 적색, 녹색, 자주색을 구분하기 어려운 반면, 청색맹은 청색, 황색을 구분하기 어렵다. 망막색소변성 환자에서 색각이상은 시력과 나이에 따라서 형태에 차이가 없었으며, 시력이 20/40 미만이고 중심와에 병변이 있을 때 더 안 좋았다. 따라서 색각검사가 망막색소변성 환자의 진단과 기능 평가에서 중요한 역할을 할 수 있다.
읽기 속도(reading speed)와 독해력
글을 읽고 이해하는 것은 중요한 기능적 시기능 중 하나이다. 시력이 비교적 좋은 망막색소변성 환자에서도 독서가 어렵다는 것은 이미 잘 알려져 있다. 하바드대학에서 시행한 연구에서 색소변성 환자의 독서 속도와 대비감도 사이에 관련성이 높다고 하였다[16]. 즉, 대비감도가 낮을 때 독서 속도의 감소가 크게 나타났다. 따라서 글자를 선명하게 하거나 선명도와 대비가 높은 모니터를 사용하는 것이 망막변성 환자에게 도움을 줄 수 있을 것으로 기대할 수 있다.
망막변성으로 인해서 독해력이 감소할 수 있다. 최근 나이관련황반변성 환자를 대상으로 독서 속도와 독해력을 연구하였는데, 황반변성 환자에서 독서 속도는 대조군과 큰 차이가 없었지만 일정 시간 이상 글을 읽고 내용을 이해하는 능력은 많이 감소하였다[17]. 이러한 독해력의 차이는 이해력의 차이가 아니라 환자들이 잘 안 보이는 상황에서 천천히 정확하게 보기 보다는 빠른 독서 속도를 선택한 결과라고 해석할 수 있다. 따라서 망막변성 환자들이 일상생활에서 조금 더 편하게 글을 읽을 수 있도록 충분한 시간을 배려하는 사회적인 노력이 필요하다.
운전 능력
운전은 안전과 직결되는 활동이기 때문에 운전자의 시기능이 안전 운행에 적합한지 필수적으로 고려되어야 한다. 중심시력, 주변부 시야, 대비감도, 야간시력 등 여러 요소가 복합적으로 운전 능력과 관련된다[18]. 망막색소변성에서 비교적 늦게까지 유지되는 중심시력과 달리 시야위축은 점점 진행된다. 미국에서 시행된 인구집단을 대상으로 한 연구에서 녹내장이 있는 경우 자동차 충돌사고의 위험이 증가한다고 하였다[19]. 시야장애가 진행된 녹내장에서는 자동차 사고의 위험이 같은 연령의 대조군에 비해 시야장애의 정도가 위중할수록 충돌 위험이 증가하는 것으로 나타났다[20]. 또한 대비감도가 낮은 환경에서는 자동차 사고의 위험이 증가하는 것으로 보고되고 있다[21]. 한편 망막색소변성에서 초기부터 나타나는 증상인 야간시력저하의 경우 측정 방법이나 그 영향에 대하여 많은 연구가 이루어져 있지는 않다. 현재의 운전면허 기준은 시력과 시야장애를 바탕으로 하고 있는데, 여러 가지 시기능이 질병의 진행 정도에 따라 복합적으로 저하될 수 있는 망막색소변성의 경우 환자의 시기능 상태를 종합적으로 고려하여 운전이 가능한지를 판단하여야 한다.
Notes
The authors have no conflicts to disclose.