하시모토 갑상선염과 동반된 비동맥염성 앞허헐시신경병증
Nonarteritic Anterior Ischemic Optic Neuropathy Simultaneously Associated with Hashimoto’s Thyroiditis
Article information
Trans Abstract
Purpose
To report one case of nonarteritic anterior ischemic optic neuropathy (NAION) simultaneously associated with Hashimoto’s thyroiditis.
Case summary
A-51-year-old man with no underlying disease and painless blurring of vision in his left eye that lasted for a week visited our office. His best-corrected visual acuity was 20/20 in the right eye and 20/1,000 in the left eye. Ophthalmological examination showed a relative afferent pupillary defect in the left eye. Fundoscopic examination revealed swelling of the left optic disc; however, orbital magnetic resonance imaging was normal. Visual field testing by automated perimetry showed a dense central scotoma defect in the left eye. The possibility of optic neuritis was considered; thus, intravenous methylprednisolone (1 g/day) was initiated for 3 consecutive days. Three days after therapy, his visual field showed an inferior altitudinal defect; thus, anterior ischemic optic neuropathy was diagnosed in the left eye. Before the therapy, the anti-thyroid peroxidase antibody level was high, and Hashimoto thyroiditis was detected by thyroid ultrasonography.
Conclusions
This is the first reported case of NAION associated with concurrent Hashimoto’s thyroiditis. Notably, the patient had none of the risk factors associated with NAION.
비동맥염성 앞허혈시신경병증은 갑자기 발생하는 단안의 무통성 시력저하, 하측 또는 상측의 수평 시야장애, 상대구심동공운동장애 및 시신경유두부종 소견을 동반한다[1]. 시신경유두부(optic nerve head)에 혈액을 공급하는 동맥고리 문합부(anastomotic arterial circle)는 짧은뒤섬모체동맥으로부터 기인하고, 이는 상측과 하측을 구분하여 순환하는 구조로 비동맥염성 앞허혈시신경병증 환자에서 시야검사를 시행하면 수평반맹(altitudinal hemianopia)이나 활꼴(arcuate) 형태의 시야결손을 보이는 경우가 많다[2].
전신적으로 뒤섬모체동맥 관류압을 감소시킬 수 있는 야간 저혈압, 고혈압, 당뇨, 고지혈증, 허헐성 심질환, 동맥경화, 빈혈, 혈액응고이상 등의 전신질환과 안구 자체의 요인인 작은 시신경유두함몰비, 안압상승, 수면 무호흡증, 흡연 등이 위험인자로 알려져 있으며[3-6], 그 외 자가면역질환과 연관된 비동맥염성 앞허혈시신경병증이 드물게 보고되고 있다[7-11]. 특별한 위험인자가 없는 환자에서 비동맥염성 앞허헐시신경병증이 하시모토 갑상선염과 동반된 증례를 경험하였기에 이를 보고하고자 한다.
증 례
기저질환이 없는 건강한 51세 남자가 1주 전부터 시작된 좌안의 무통성 중심부 시력저하로 내원하였다. 최대교정시력은 우안 1.0, 좌안 0.02로 측정되었고, 교대불빛검사에서 좌안의 상대구심동공운동장애가 확인되었으며, 안저검사 및 빛간섭단층촬영에서 우안은 정상 소견을 보였으나(Fig. 1A) 좌안은 시신경유두부종 소견이 관찰되었다(Fig. 1B). Humphrey 자동시야검사에서 좌안은 두꺼운 중심부 암점 소견을 보였으나(Fig. 2A), 우안은 정상이었으며(Fig. 2B) 안와 자기공명영상에서는 특이 소견이 관찰되지 않았다. 좌안이 시신경염일 가능성이 있어서 우선 메틸프레드니솔론(methylprednisolone) 정맥주사(1 g/day) 치료를 3일간 시행하였다. 주사 치료 3일째 시야검사에서 좌안 하부 수평 시야결손으로 나타나서 시신경염이 아닌 앞허혈시신경병증으로 진단하였다(Fig. 2C).
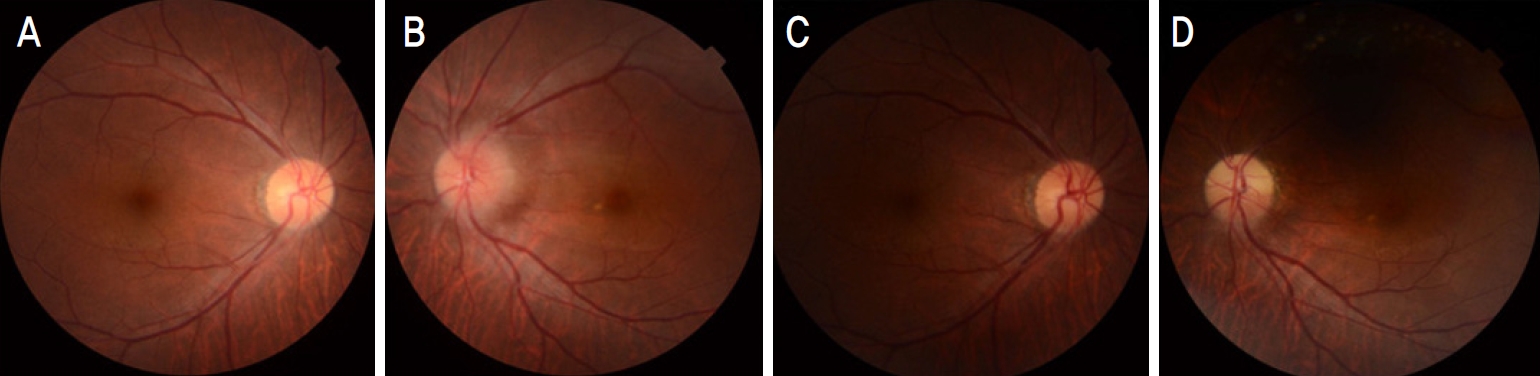
Initial fundus photography revealed a clear optic disc margin in the right eye (A) and blurred optic disc margin in the left eye (B). After 2 months, fundus photography showed normal optic disc margin in the right eye (C) but, temporal optic disc pallor in the left eye (D).
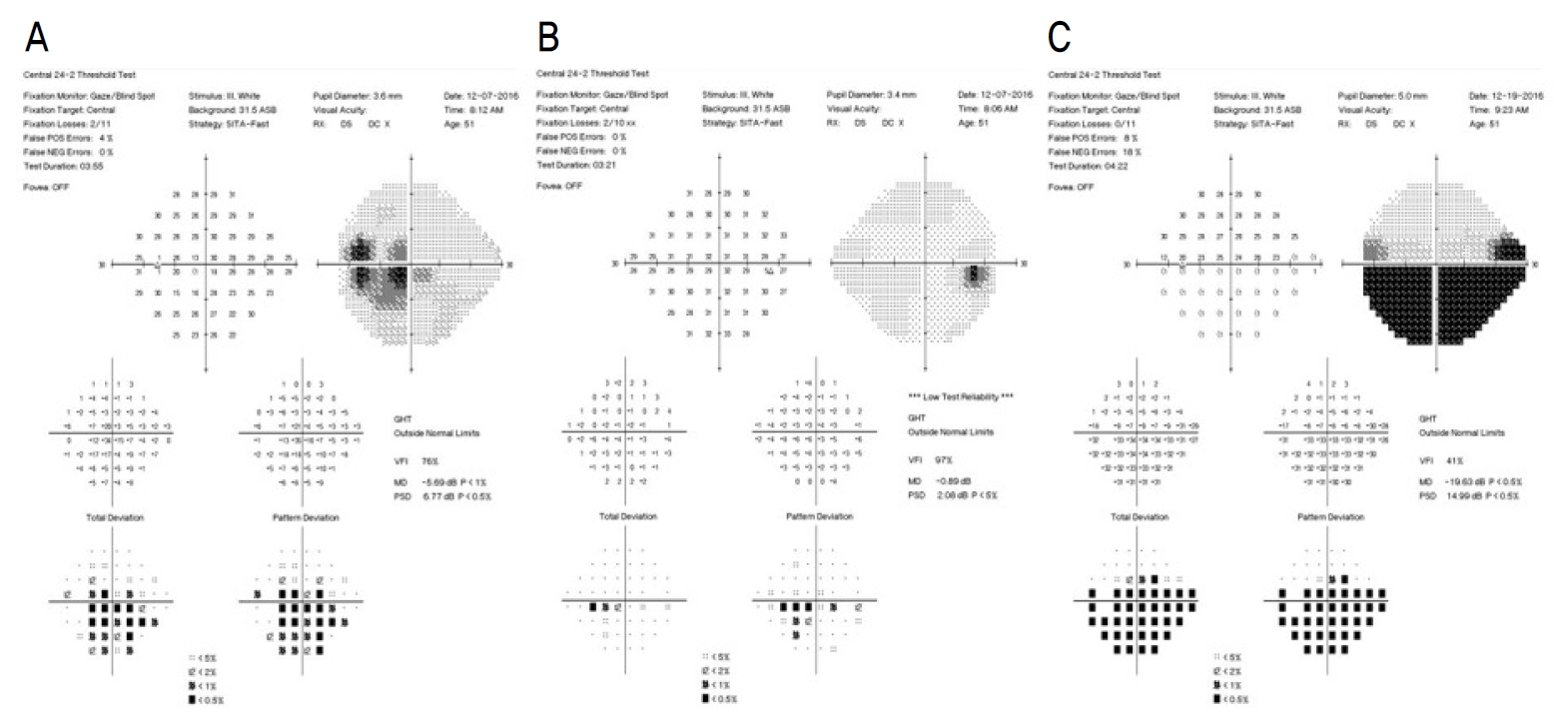
Initial visual field test demonstrated central altitudinal scotoma in the left eye (A) but no visual filed abnormalities in the right eye (B). On the third day after the therapy, his visual field was showed left inferior altitudinal defect (C). GHT = glaucoma Hemifield test; VFI = visual field index; MD = mean deviation; PSD = pattern standard deviation.
치료 전 시행한 혈액검사에서 혈당, 지질단백질, 콜레스테롤 수치를 포함하여 이상 소견은 보이지 않았고, Aquaporin-4 antibody, 항핵항체(antinuclear antibody), 부수종양성 항체 검사(paraneoplastic antibody test), 여러 바이러스 항체 등을 포함한 검사 결과 또한 음성이었다. 뇌척수액검사에서도 oligoclonal band을 포함하여 특이 소견은 보이지 않았다. 면역혈액검사에서 혈청 항갑상선글로불린항체(anti-thyroglobulin antibody)는 12.1 IU/mL, 갑상선자극호르몬(thyroid stimulating hormone)은 0.365 μIU/mL, 혈청 유리 티록신(free thyroxine)은 0.80 ng/dL로 정상이었으나, 항갑상선과 산화효소항체(anti-thyroid peroxidase antibody)의 수치가 2,811 IU/mL로 임상적으로 유의하게 높게 측정되었다. 갑상선기능저하증을 의심하여 본원 내분비내과와의 협진 아래, 갑상선 초음파검사를 시행하였고, 갑상선 초음파검사에서 만성 갑상선염인 하시모토 갑상선염 소견이 관찰되어 하시모토 갑상선염의 진단 기준에 합당한 것으로 진단되었다.
진단 2개월 후 안저검사에서 우안은 정상 소견인 반면(Fig. 1C) 좌안은 시신경유두 상측에서 창백 소견이 보이고(Fig. 1D), 시야검사에서 좌측 하부 수평 시야결손의 호전없이 지속되는 양상이 관찰되었으며, 이는 최종적으로 하시모토 갑상선염과 동반된 비동맥염성 앞허헐시신경병증으로 확진할 수 있었다.
고 찰
하시모토 갑상선염은 장기 특이적 T림프구 매개 질환(organ-specific T-cell mediated disease)으로, 면역세포가 갑상선에 다수 침착하여 염증을 일으켜 갑상선세포가 파괴되면서 발병하며, 임상증상, 갑상선기능검사와 갑상선자가 항체검사를 토대로 진단한다[12]. 임상증상으로는 전신부종, 식욕저하, 체중 증가 등이 있고 갑상선이 커져 대개 단단하게 촉진될 수 있으나, 보통 수년에 걸쳐 느리게 진행되므로 혈액검사에서 갑상선자가항체가 검출되어도 초기에 아무런 증상이 없는 경우도 있다. 본 환자 또한 특별한 증상 없이 앞허혈시신경병증과 동반하여 우연히 진단되었다.
앞허혈시신경병증의 기전은 흔히 시신경유두부의 소혈관 순환장애가 원인으로 생각되나 아직 정확하게 밝혀지지 않았다[2]. Brouzas et al [13]은 세 명의 만성 빈혈과 동반된 앞허혈시신경병증의 증례 보고에서 빈혈성 저산소증과 미세혈관 순환장애가 원인이라고 설명하였고, Dammacco [7]는 전신홍반루푸스(systemic lupus erythematosus)에서 면역 복합 침전물 또는 자가항체에 의한 시신경의 작은 혈관 폐쇄를 일으켜서 허혈시신경병증이 발생할 수 있다고 한 바 있다. 항인지질 증후군(antiphospholipid syndrome)에서도 자가항체의 미세순환(microcirculation)에 의해 혈관 내 혈전이 생성되어 시신경병증을 일으킬 수 있다[8]. 이외에도 에디슨병(Addison’s disease), 쇼그렌증후군(Sjögren’s syndrome), 특발성 자가면역 혈소판감소증(Idiopathic autoimmune thrombocytopenia), C형간염(hepatitis C) 등에서도 미세혈관 순환장애 또는 폐쇄가 발생하면서 비동맥염성 앞허혈시신경병증이 드물게 보고되고 있다[9-11,14].
본 환자에서 진단된 하시모토 갑상선염이 비동맥염성 앞허혈시신경병증 발생과의 연관성에 대해서는 정확하게 알 수 없다. 다만 하시모토 갑상선염은 T림프구 매개 자가면역질환으로 짦은뒤섬모체동맥을 포함한 시신경 주위 미세혈관 순환에 영향을 줄 수 있다. 갑상선 내에서 자가면역반응으로 형성된 면역 복합체가 시신경주위 미세혈관 순환장애를 일으켰을 수도 있고, 또는 자가면역반응에 의한 혈전 형성이 시신경유두의 허혈을 발생하였을 것으로 추정해 볼 수 있다. 추후 앞허혈시신경병증의 진단 시에 하시모토 갑상선염 등과 같은 미세혈관 순환장애를 일으킬 수 있는 자가면역질환에 대한 충분한 검사 및 동반 가능성에 대하여 고려해봐야 할 것으로 생각된다.
본 증례는 비동맥염성 앞허혈시신경병증이 하시모토 갑상선염과 동시에 진단된 첫 증례이다. 비동맥염성 앞허혈시신경병증이 의심되는 환자를 진단할 때 하시모토 갑상선염과 같은 자가면역질환의 동반 가능성에 대한 충분한 고려가 필요하고, 앞으로도 하시모토 갑상선염과 앞허혈시신경병증의 연관 가능성에 대한 연구가 필요할 것으로 생각된다.
Notes
The authors have no conflicts to disclose.