미세먼지 농도의 변화가 안구건조증의 임상 양상에 미치는 영향
Clinical Impact of Ambient Particulate Matters on Dry Eye Disease
Article information
Abstract
목적
안구건조증은 흔한 안구표면 질환으로 주변 환경의 영향을 받을 수 있다. 본 연구에서는 안구건조증과 대기 오염물질과의 관련성을 알아보고자 하였다.
대상과 방법
안구건조증으로 진단된 총 216명을 대상으로 후향적 분석을 시행하였다. 매달 신환 18명을 등록하였다. 안구표면 자각증상점수 설문조사(OSDI), 눈물막파괴시간(TFBUT), 각막염색점수(FCS), 쉬르머검사(ST1)를 시행하였고 기상청에서 제공한 2018년 12개월의 대기오염농도 데이터를 얻었다. PM10과 PM2.5 평균값을 기준으로 미세먼지 농도가 높은 시기(H-PM)와 낮은 시기(L-PM)에 노출된 그룹으로 나눠 분석하였다.
결과
환자들은 높은 OSDI, 낮은 TFBUT, FCS 증가, ST1 감소 소견을 보이는 중등도의 건성안 소견을 보였다. 2018년동안 미세먼지 농도의 월별 추이를 보면 5월부터 10월까지는 낮은 미세먼지 농도를 보였고 1월부터 4월까지 그리고 11월과 12월에는 높은 미세먼지 농도를 보였다. 하위그룹 고미세먼지에 노출된 환자들은 저미세먼지에 노출된 환자들보다 통계적으로 유의하게 높은 OSDI, FCS와 낮은 ST1을 보였다. 그러나 두 그룹에서 TFBUT는 통계적으로 유의한 차이를 보이지 않았다.
결론
본 연구에서는 안구건조증의 주요인자인 눈물막 불안정성에 유의한 차이가 없음에도 불구하고, 고미세먼지에 노출된 군에서 안구건조증이 더 심하게 나타남을 보여주었다. 미세먼지가 높은 시기에 안구건조증이 악화될 수 있으며, 이는 환경 염증 유발 인자들이 눈물 분비 및 안구표면에 영향을 준다는 것을 시사한다.
Trans Abstract
Purpose
Dry eye disease (DED) has become a common ocular surface disorder in the recent decades, which can be influenced by environmental factors. This study aimed to examine the clinical association between DED and ambient air pollutants.
Methods
A total of 216 patients (18 patients per each month) diagnosed with DED were enrolled in this retrospective study. Ocular surface disease index (OSDI), tear film breakup time (TFBUT), fluorescein corneal staining (FCS), and Schirmer’s test 1 (ST1) were examined. The monthly concentrations of air pollutants in 2018 were obtained from the data released by the Korean Ministry of Environment. Based on the mean of PM10 and PM2.5, subgroup with exposure to low (L–PM) or high concentration of PM (H–PM) was analyzed.
Results
Patients had moderate DED as high OSDI, low TFBUT, increased FSC, and decreased ST1. During the year 2018, monthly variation of PM showed that May to October was the period of L-PM and January to April and November to December was the period of H-PM. In subgroup analysis, patients in H-PM showed significantly higher OSDI, FCS, and lower ST1 compared to in L-PM. However, there was no significant difference in TFBUT between subgroups.
Conclusions
DED was more severe in the period of H-PM than L-PM even though there was no difference in tear film instability between both periods. Ambient inflammatory factors including PM might deteriorate ocular surface as well as tear secretion, resulting in aggravating DED.
서 론
환경 오염에 대한 인류의 관심은 점점 더 고조되고 있으며, 많은 연구에서 환경 오염이 인간의 건강을 다방면으로 해칠 수 있음을 보여주고 있다[1-3]. 입자상 물질(particulate matter, PM)은 전세계적인 대기오염 물질이며 공기 중에 떠다니는 고체 및 액체 입자의 혼합물로 구성되어 있는데, 직경이 10 μm 미만인 PM을 미세먼지(PM10), 2.5 μm 미만을 초미세먼지(PM2.5)라고 하여 대기 오염의 심각성을 평가하는 지표 중 하나이다. 주로 연료의 연소(자동차 배기 및 석탄 연소 등)에서 비롯되며 많은 양의 유기 물질(벤조 피렌 및 다환 방향족 탄화수소 등)을 포함하여 매우 복잡한 구성을 가지고 있으며 수많은 무기 구성 요소, 황산염, 질산염 및 중금속(납 및 니켈) 등을 포함한다. PM은 폐로 흡입되어 직접적으로 천식, 폐쇄성 폐질환 등의 호흡기질환을 일으키며, 제거되지 못한 채 전신 혈류로 흡수되어 뇌경색, 심근경색 등의 심뇌혈관 질환 및 알츠하이머 등의 퇴행성 뇌질환까지도 유발할 수 있다고 보고되고 있다[4-9].
안구건조증은 눈물막의 안정성 및 항상성 소실로 인하여 안구 표면의 손상을 유발하는 염증성 면역 질환으로, 다양한 인자가 관여하여 가려움, 빛 번짐, 이물감 등에서부터 시력저하, 눈 통증 등의 심각한 안구 증상을 일으킬 수 있다[10-12]. 이러한 안구건조증은 가장 흔한 안구 표면 질환으로, 여러 국가에서 실시된 많은 연구들의 보고에 따르면 그 유병률이 34%까지 달한다[13]. 뿐만 아니라, 눈의 기능에 영향을 주는 것 외에도 환자의 일상 활동, 정서 등 다양하게 삶의 질에 영향을 미칠 수 있다[14]. 매우 특징적으로 다른 장기와 달리, 안구 및 눈물은 항시 대기 환경에 노출되어 있기 때문에 안구건조증 역시 환경적 요인의 영향이 크게 작용한다. 대기 환경의 오염물질인 PM이 안구 표면에 미치는 기전을 밝히기 위하여, 다양한 안구 표면 세포주 모델 실험[15-18] 혹은 동물 모델 실험[18-24] 등의 기초연구가 활발히 이루어지고 있다.
안구 표면은 대기 환경과 항시 접촉하는 특성으로 인하여 PM이 직접적인 영향을 미칠 수 있음에도 불구하고, 안구 표면 질환의 발생에 대해 PM과의 연관성을 알아본 임상 연구는 많지 않다[25-30]. 과거 보고된 타 국가의 역학 연구에 따르면, 대만에서 안구 표면 질환 중 비특이적 결막염의 유병률은 PM10의 농도에 따라 증가한다고 하였으며[28], 중국에서 수행한 안구건조증과 PM의 상관관계 연구에서는 PM2.5가 통계적으로 유의한 위험인자임을 보고하였다.27 국내 연구 중에서 안구건조증과 PM과의 관계를 역학적으로 분석한 것들이 있는데, PM10이 유의하게 관련이 있다는 보고[29]와 그렇지 않다는 보고[30]가 공존한다. 또한, 국내의 특정 지역 응급실에 내원한 환자들의 추이를 분석한 연구에서는, 결막염 및 각막염을 주소로 내원한 환자들의 비율이 PM10과 연관성이 있다는 연구도 있다[25].
본 연구는 2018년 국민건강보험공단 일산병원에 내원하여 안구건조증을 진단받은 환자들을 대상으로 하였고, 단순히 질환의 유무만을 확인하는 역학적 연구가 아니라 안과적 전문 진료를 통하여 안구 표면 상태를 대변할 수 있는 특이 임상지표들을 분석하였다. 환자들의 거점을 토대로 해당 지역의 PM을 포함한 대기오염물질의 연중 변화를 환경부를 통해 확인하였으며, PM2.5 및 PM10의 농도에 따라 안구건조증의 중증도에 차이가 있는지 알아보았다.
대상과 방법
2018년 1월부터 2018년 12월까지 국민건강보험공단 일산병원을 내원한 초진 환자 중 만 19세 이상의 안구건조증을 진단받은 성인 216명에서, 증상이 더 심한 쪽 눈을 대상으로 후향적 연구를 진행하였다. 본 연구는 국민건강보험공단 일산병원 기관윤리위원회(Institutional Review Board)의 승인 하에 진행되었으며 후향적 연구로 환자 동의서는 면제 받았다(IRB No. NHIMC 2018-04-030). 모든 환자들은 이전에 히알루론산 외에는 건조증 치료제를 사용한 과거력이 없었다. 안구건조증은 안구건조감, 이물감, 통증, 시력 저하 등의 자각증상이 있으면서, 형광 염색 상 눈물막파괴시간(tear film breakup time, TFBUT)이 5초 미만이거나 또는 세극등 현미경 상 형광 염색으로 각막 염색 점수(fluorescein corneal staining, FCS)가 확인되는 경우로 정의하였다[11]. 각막 상태에 영향을 줄 수 있는 당뇨나 스티븐-존슨 증후군, 뇌질환 수술력 등의 전신 질환이 있거나 안구건조증 외 다른 안구표면 질환을 가진 자, 각막 독성이 알려진 전신 약물치료를 받고 있거나 녹내장 점안약을 사용 중인 자, 콘택트렌즈 사용자, 안과적 수술력이 있는 자, 안과적 외상력이 있는 자는 연구 대상에서 제외하였다. 모든 대상자는 진료 전 안구표면 자각 증상 점수 설문 조사(ocular surface disease index, OSDI)를 작성한 후, Schirmer strip (35 mm Whatman filter paper strip; Haag-Streit, Koeniz, Switzerland)을 아래 눈구석 결막에 5분간 마취없이 접촉하여 눈물량을 측정하였다(Schirmer’s test 1, ST1) [31]. TFBUT의 측정은 플루오레신 염색약(fluorescein strip; Haag-Streit)을 이용하여 각막을 염색한 후 평가하였고 안구표면의 미란 정도는 기존에 알려진 Oxford schema의 플루오레신 염색약을 이용한 Grading system을 사용하였다[32]. 모든 대상자의 안과적 이학적 검사는 각 항목 간 10분 이상의 간격을 두고 한 명의 안과 전문의(JYW)에 의해서 행해졌다.
PM10, PM2.5 미세먼지를 비롯한 sulfur dioxide (SO2), carbon monoxide (CO), ozone (O3), nitrogen dioxide (NO2) 등의 대기오염물질의 농도는 한국환경공단(www.airkorea.or.kr) 에서 제공하는 공개데이터를 이용하였다. 전국의 대기오염 측정망에서 측정되는 PM10, PM2.5, SO2, CO, O3, NO2 등 대기오염의 자료를 수집·관리하는 국가 대기오염 정보관리 시스템(National Ambient air quality Monitoring Information System, NAMIS)을 통하여 대기환경정책 자료로 활용할 수 있도록 제공하는 정보로써, 전국 112개 시, 군에 설치된 398개의 도시대기 측정망, 도로변대기 측정망, 국가배경 측정망, 교외대기 측정망에서 측정된 대기환경기준물질의 측 정자료이다. 이 중, 2018년 1월 1일부터 12월 31일까지 매일 매시마다 측정된 대기오염물질의 농도 데이터를 이용하였으며 월 기준으로 평균 값을 산출하였다. 그중 PM10과 PM2.5에 초점을 맞추었고, 각각의 평균값을 기준으로 미세먼지 농도가 높은 시기(subgroup of dry eye patients with exposure to high concentration of ambient particulate matter, H-PM)와 낮은 시기(subgroup of dry eye patients with exposure to low concentration of ambient particulate matter, L-PM)로 나누어 보고자 하였다. 본원에 내원하는 환자들을 대상으로 연구를 진행하였으므로, 이들이 거주하는 지역 및 병원 주변의 환자분포 지역권을 포함하여 대기오염물질 농도 조사의 범위로 정하였다. 즉, 경기도 고양시, 파주시, 김포시, 서울 은평구 등의 지역에 한하여 대기오염 데이터를 활용하였다. 기상청 날씨누리(https://www.weather.go.kr)에서 연구 범위로 설정한 지역에서 얻을 수 있는 범위 내의 상대습도 데이터를 제공받아 이용하였다.
통계 분석은 SPSS 21.0 소프트웨어(IBM Corp., Armonk, NY, USA)를 사용했다. 고농도 미세먼지 그룹(H–PM)과 저농도 미세먼지 그룹(L–PM) 간의 분석은 Mann–Whitney test 검정을 이용하였다. p값이 0.05 이하인 경우를 통계적으로 유의한 것으로 판정했다.
결 과
2018년 1월부터 12월 31일까지 본원 안과를 내원한 환자 중, 대상자 적응증에 부합한 216명(216 안)의 안구건조증 환자가 연구에 포함되었다. 안구건조증을 진단받은 환자들은 성별과 나이를 고려하여 각 월별 18명씩 후향적으로 선정되었고, 전체 환자들의 평균 연령은 58.4 ± 15.1세였으며, 66.7%가 여성이었다.
안구건조증에 관한 임상적 평가를 시행한 결과, 환자의 주관적 증상을 수치화한 OSDI 점수는 평균 27.9 ± 23.3점(중위수 22.5점)으로 중등도 이상의 중증도를 보였다. 안구건조증의 주요기전 중 하나인 불안정한 눈물막을 대변하는 지표인 TFBUT는 평균 4.5 ± 1.9초(중위수 4초)로 안구건조증의 진단기준에 부합하였다. 눈물의 생성 분비량을 뜻하는 ST1 지표는 평균 8.6 ± 2.3 mm (중위수 8 mm)로 약간의 감소는 있으나 심하지는 않았다. 안구표면의 FCS 점수는 평균 1.8 ± 1.3 (중위수 1)로, 다인자 염증질환인 안구건조증의 병적 양상에 부합하였다(Table 1).
한국환경공단에서 제공하는 공개데이터를 이용하여 2018년 1월부터 12월까지 매일 한 시간 간격으로 24시간 내내 측정되는 PM10, PM2.5, SO2, CO, O3, NO2의 대기오염물질 농도를 살펴보았고 기상청 날씨누리에서 제공하는 상대습도도 살펴보았다. 연구 지역범위 내에서 파주시의 상대습도 데이터만 얻을 수 있었으며, 데이터들의 각 월별 평균 수치는 Table 2와 같다. PM10의 2018년 연평균 농도는 44.72 μg/m3이었고 PM2.5의 2018년 연평균 농도는 25.26 μg/m3였다. 연평균 상대습도는 72.92%였다. 이를 기준으로 각각의 월별 대기농도의 분포를 구분해보니 두 가지 PM에서 공통적으로 5, 6, 7, 8, 9, 10월의 6개월이 L-PM에 해당하는 시기였고, 1, 2, 3, 4월 및 11, 12월의 6개월이 H-PM에 해당하는 시기였다(Fig. 1A). 연평균 상대습도를 기준으로 분류하면 L-PM 기간에 높은 상대습도가 관찰되었고, H-PM 기간에 낮은 상대습도가 측정되었다. H-PM과 L-PM으로 구분한 기간 동안에, 다른 대기오염물질인 CO, O3, NO2, SO2는 유의한 차이가 없었다(Fig. 1B).
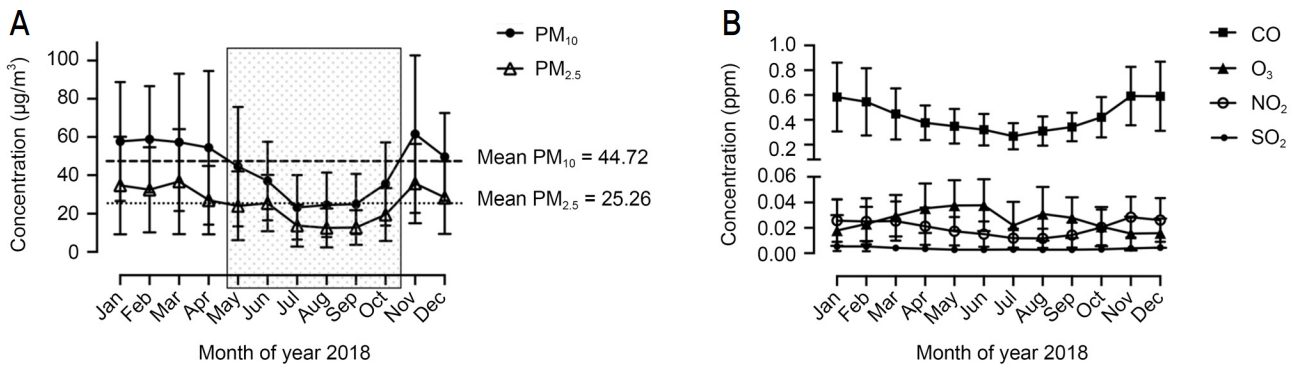
Monthly variations in ambient air pollutant concentrations in the year 2018. (A) Ambient particulate matter (PM) with aerodynamic diameter ≤ 10 μm (PM10) and ≤ 2.5 μm (PM2.5). The box indicates the period with low concentration of ambient PM based on the mean concentration. (B) Carbon monoxide (CO), ozone (O3), nitrogen dioxide (NO2), and sulfur dioxide (SO2). All air pollutant concentrations were measured in Goyang-si, Paju-si, Gimpo-si (Gyeonggi-do) and Eunpyeoung-gu (Seoul).
H-PM과 L-PM으로 구분한 기간의 안구건조증 환자들의 증상 및 임상 소견을 비교해보았다. Table 3과 같이 두 하위그룹은 동일하게 6개월의 기간에 해당되므로 각각 108명의 환자 데이터를 하위그룹 분석할 수 있었다. 두 그룹 간의 연령, 성별 등은 차이가 없었다. 그러나, 안구건조증 증상인 OSDI 점수가 H-PM군에서 L-PM군보다 유의하게 높았다(36.3 ± 23.2 vs. 25.3 ± 19.8). 이와 상응하게, H-PM군에서 FCS가 통계적으로 유의하게 1.8배 더 높았고(2.7 ± 1.2 vs. 1.6 ± 1.3), 눈물 분비량(ST1)은 유의하게 약 45% 줄어 있었다(4.9 ± 2.6 mm vs. 8.7 ± 4.3 mm). 흥미롭게도, 눈물막의 불안정성을 뜻하는 TFBUT는 두 군 간의 유의한 차이가 없었다(4.5 ± 1.8 s vs. 4.6 ± 1.5 s) (Fig. 2).

Comparisons of clinical parameters among subgroups of dry eye patients according to exposure to low or high concentrations of ambient particulate matter
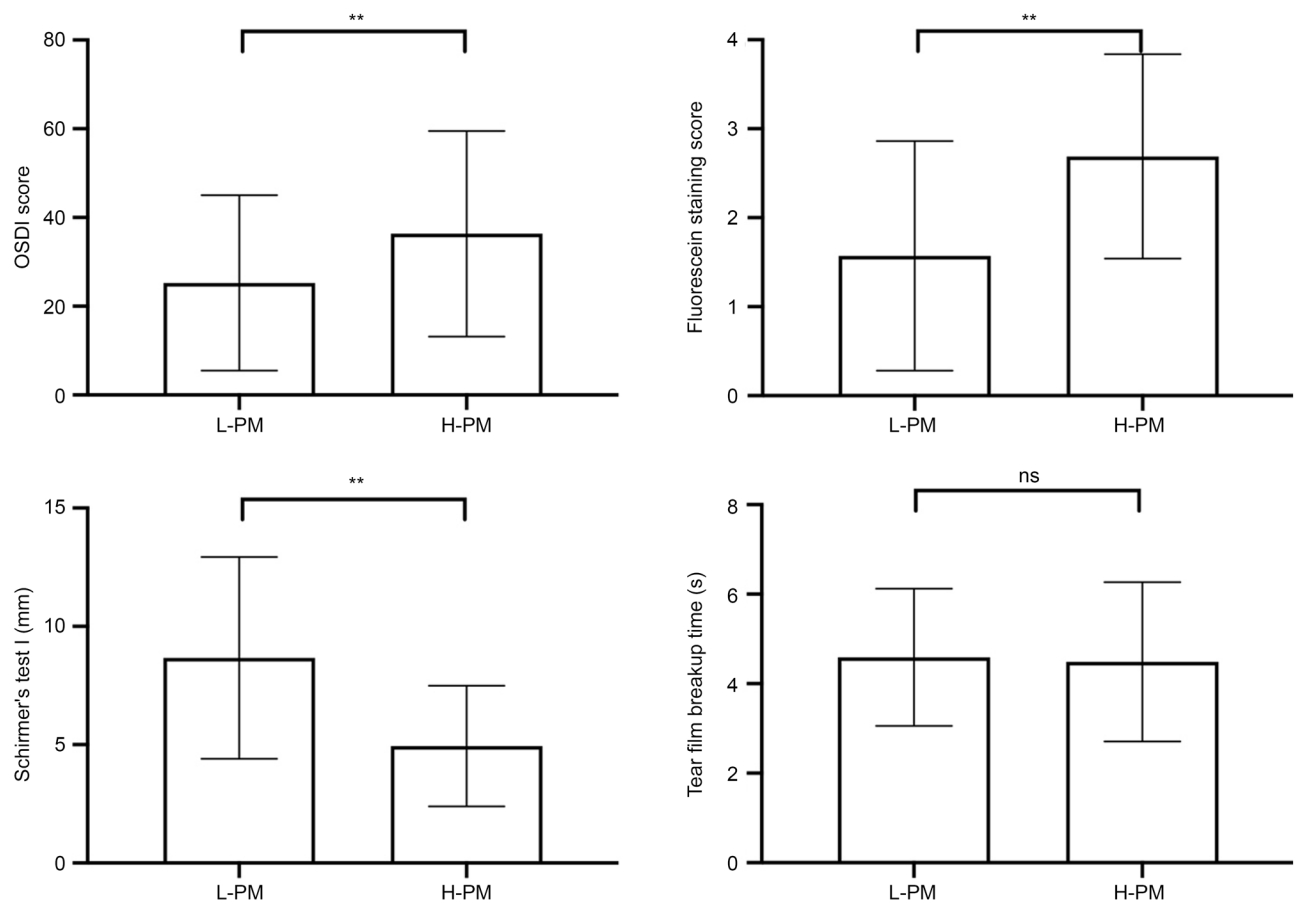
Comparison of clinical signs and symptoms between subgroups of dry eye patients in the year 2018. ns = not significant; OSDI = ocular surface disease index; L-PM = subgroup of dry eye patients with exposure to low concentration of ambient particulate matter; H-PM = subgroup of dry eye patients with exposure to high concentration of ambient particulate matter. p-values for comparisons between groups were determined with Mann–Whitney test. **p < 0.01.
고 찰
본 연구는 대기오염물질, 특히 미세먼지가 안구건조증에 어떠한 영향을 줄 수 있는지를 알아보았다. 1년 중 미세먼지 PM10, PM2.5의 농도가 각각 어떻게 변하는지 그 추이를 먼저 살핀 후, 평균값을 기준으로 미세먼지농도가 높은 시기와 낮은 시기 두 가지로 구분을 하였다. 환자가 미세먼지를 접하면 신체, 특히 안구표면의 변화가 일어나는 데에는 시간이 필요할 것이고 반복적인 미세먼지의 영향이 누적되어야 어떠한 병적 소견을 유발할 수 있기 때문이다. 그 결과, 미세먼지 농도가 높은 1-4월 및 11-12월 시기에는 안구건조증 환자들의 증상과 임상 소견들이 더 나쁘다는 사실을 확인할 수 있었다. 해당기간은 높은 미세먼지 농도로 인해 안구표면의 염증 소견이 더 확연해지고 눈물 자체의 분비량이 많이 줄어들었으며, 반면에 눈물막의 불안정성에는 변화가 없었다.
일반적으로, 안구건조증은 눈물막의 불안정성이 가장 기본적인 기전이며, 여기에 다양한 메커니즘이 동반되면서 다인자성 요인으로 환자들의 안구표면에 손상을 일으킨다[33]. 눈물의 생성 자체가 저하되면서 안구건조증이 악화될 수 있는데, 이는 유전적 요인, 연령, 성별, 호르몬 불균형, 전신 질환(당뇨, 자가면역질환), 콘택트 렌즈 착용, 방부제 함유 안약 사용 및 안과적 수술 등의 다양한 요인으로부터 기인한다[14,34]. 한편, 과도한 눈물의 증발 역시 안구건조증에서 중요한 메커니즘인데, 이로 인한 눈물 삼투압 증가는 각 결막 상피 세포의 염증 반응을 일으키게 된다[14]. 염증 반응은 TNF-α, IL-6, IL-17 등의 염증 인자를 생성하도록 하여 세포 사멸을 유도하고 면역세포들의 활성화를 일으킴은 물론, 점액 분비를 감소시켜 눈물의 안정성에 영향을 주게 되어 결국 악순환을 유발한다[35,36].
미세먼지에 안구 표면이 노출된 경우, 주요 염증 싸이토카인인 IL-1β 및 TNF-α 등의 생성으로 인하여 안구표면의 염증이 심화되고 안구표면의 상피세포들에 독성을 일으켜 세포자멸사를 유발한다는 것이 여러 동물 연구를 통하여 이미 제시된 바가 있다[18,21,23]. 이 때문에 낮은 TFBUT, FCS 증가가 나타날 수 있고 주관적인 안구불편감이 발생하여 높은 OSDI의 결과를 가져온다. 또한, 국내 전향적 연구에서 PM10은 눈물막의 안정성만을 저하시키고, PM2.5는 안구 불편감과 눈물 분비를 증가시켰으며, 각각의 대기 오염물질이 다른 작용 메커니즘을 통해 안구건조증을 악화시킬 수 있다는 점도 알려져 있다[37]. ST1의 감소는 눈물샘의 기능저하 또는 염증이 원인일 수 있는데 마치 쇼그렌 증후군처럼 전신의 염증반응이 눈물샘에도 악영향을 미쳐 그 기능이 떨어지는 것으로도 생각해볼 수 있다. 반복적으로 높은 농도의 미세먼지에 노출될 경우 앞서 언급한 전신 염증 메커니즘이 발생하여 만성적인 안구 표면 염증이 발생하고 눈물샘의 염증으로 눈물생성에 영향을 받아 H-PM군과 L-PM군 두 군에서 유의한 FCS, ST1 차이를 유발할 수 있을 것이라고 생각된다. 눈물막의 불안정성을 나타내는 TFBUT는 미세먼지 노출에 의해 영향을 받으나 농도에 따른 차이는 다른 지표들에 비해 상대적으로 적다고 생각해볼 수 있다.
미세먼지가 우리 몸에 침투하면 강제로 배출할 방법이 없어 언제 어떤 문제가 발생할지 정확히 알지 못한 채 평생 살아가야 한다는 데 큰 문제가 있다[3,6,8]. 또한 체내 섬모에서 여과되지 않은 채 신체 각 기관에 직접 도달할 수 있고 폐포를 통과해 혈관에 침투하기도 한다. 이렇게 신체 각 기관에 도달한 미세먼지가 염증 반응을 일으켜 심장질환과 호흡기 질병을 발생시킨다는 것은 이미 잘 알려져 있다[9,21].
대기오염물질과 안구건조증의 관계에 대해서는 많이 알려져 있지 않으나, 연구자들마다 견해가 약간씩 다르다. 우리나라에서 시행하였던 Hwang et al [30]의 연구에 따르면, 높은 O3 레벨과 낮은 습도가 안구건조증 유병률과 관련이 있는 반면 PM10 레벨은 안구건조증과 통계학적으로 관련이 없었다. 저자들은 2010년부터 2012년까지 진행된 국민건강 영양조사 설문을 통해 후향적 연구를 진행하였는데, 실제 안구표면 관련 임상 데이터를 사용하지 않고 설문자료를 이용한 점, 미세먼지 농도를 세부 기간 별로 분석하지 않은 점 등에서 본 연구와 차이가 있다. 중국의 대규모 연구에서는 O3, PM2.5 및 SO2를 포함한 대기 오염 물질은 안구건조증의 위험 요소였으며 PM10 및 NO2와는 안구건조증과 관련이 없었던 반면, CO는 안구건조증의 잠재적인 보호요소일 수 있다고 하였다[15,27]. 또한, 최근에 시행된 메타분석 연구에 따르면, 안구건조증에는 NO2 및 SO가 영향을 미치는 반면 PM10 레벨은 안구건조증에 미치는 영향이 적다는 보고도 있었으나, 분석에 사용된 19개의 연구 중 15개는 단일 그룹 연구이며, PM10을 제외한 다른 물질들에 대해서는 중간 정도의 신뢰도만을 갖고 있었고, 연구들 간의 대기오염 물질의 노출에 대한 평가방법의 차이와 안구건조증에 대한 정의가 일관되지 않는 한계를 보였다[38]. 본 연구에서는 미세먼지가 높은 시기에는 환자의 안구건조증의 양상이 더 심한 것으로 나타났으나, 인과관계를 밝히려면 동일한 안구건조증 약제를 사용하는 더 많은 수의 환자들을 대상으로 안구건조증에 영향을 줄 수 있는 여러가지 환경적인 요인들이 철저히 통제된 상황에서 미세먼지 농도에 따라 어떻게 변화하는지를 분석하는 전향적 연구가 필요하다.
주로 봄과 겨울에 미세먼지의 농도가 높았는데(H-PM: 1-4월 및 11, 12월), 우선 봄에는 이동성 저기압과 건조한 지표면의 영향으로 황사를 동반한 고농도 미세먼지가 발생할 가능성이 크다. 난방 등 연료 사용이 증가하는 겨울이면 미세먼지 농도가 높아질 수 있다. 반면, 여름과 가을에는 미세먼지의 농도가 낮았는데(L-PM: 5-10월) 여름에는 비가 자주 내리므로 미세먼지와 같은 대기오염물질이 빗방울에 씻겨 제거된다. 가을은 다른 계절에 비해 기압계의 흐름이 빠르고 지역적인 대기의 순환이 원활하기 때문에 미세먼지 농도가 낮다. 이를 줄이기 위해서 할 수 있는 국내의 노력은 사업장 감시, 경유차 제한, 가축분뇨 등 감시 등이 있겠다. 또한 상대 습도에 따른 미세먼지 농도 변화도 발생 가능하므로 이 역시 고려되어야 한다.
본 연구의 제한점은 다음과 같다. 첫째로, 한 명 한 명의 환자에서 시간에 따라 각각의 시기별 안구건조증의 상태를 종적으로 살펴보는 것이 미세먼지 농도와 안구건조증 간의 인과관계를 파악할 수 있을 것으로 사료되나, 본 연구에서는 후향적 연구의 특성상 각 시기에 해당하는 여러 환자들의 임상양상을 합쳐서 분석하였다. 따라서, 인과관계 확인에 대해 제한적일 뿐만 아니라, 안구표면질환에 미세먼지의 시기별 평균값만을 고려하고 특정 시기 안의 고농도에 피소드가 미치는 영향을 반영하지 못한 한계가 있다. 둘째로, 안구건조증의 임상지표들을 좀더 다양하고 많은 것을 포함하여 함께 분석하지 못했다는 단점이 있다. 실제로 안구건조증은 다인자 질환이며, 마이봄샘 기능장애 등이 동반되거나 주 기전일 수 있다. 셋째로, 선행연구에 따르면 상대 습도 자체가 안구건조증에 영향을 줄 수 있으며[39] 미세먼지 농도에도 영향을 줄 수 있으나 미세먼지 농도처럼 습도측정이 지역별로 세부적으로 이루어지지 않아 보정할 수 없었던 한계가 있었다. 또한, 기온 및 알러젠의 양, 겨울철 난방으로 인한 실내와 실외의 습도 차이도 안구건조증에 영향을 줄 수 있으나 환경적 변수들에 대한 객관적인 데이터를 얻는 것이 제한적이어서 배제되지 못한점을 들 수 있다. 넷째로, 각 대기오염물질의 안구표면에 영향이 미치는 점이 서로 다른 것으로 생각되나, 본 연구에서는 오직 미세먼지만을 기준으로 고농도 노출군과 저농도 노출군으로 분류를 하였으며, 각 대기오염물질의 영향을 보정하지 않은 한계가 있다[37]. 마지막으로 좀더 많은 수의 환자들을 연구에 포함한다면 하위분석을 다양하게 할 수 있으므로 추후 지속적인 연구가 필요하다.
눈은 외부 세계와 직접 접촉하므로 주변 대기환경의 변화는 안구표면에 매우 큰 영향을 미친다. 안구건조증은 매우 흔한 안구표면 질환인데, 미세먼지 등 대기오염물질이 염증을 유발하고 눈물량을 감소시키는 등의 작용을 하여 미세먼지가 높은 시기에는 환자들의 안구건조증이 악화될 수 있고, 따라서 각 시기별로 치료의 정도나 경과관찰 기간을 달리하는 등의 다른 접근이 필요한 것으로 생각되며 국가적인 차원에서는 대기오염물질을 줄이려는 노력이 필요하다.
Notes
The authors have no conflicts to disclose.
This research was supported by the research grant of National Health Insurance Service Ilsan and by the faculty research grant of Yonsei University College of Medicine (No. 6-2021-0117).

