치료 소프트콘택트렌즈에 의한 가시아메바 각막염: 그람염색에 의한 진단
Acanthoamoeba Keratitis Induced by a Therapeutic, Soft Contact Lens: Diagnosis via Gram Staining
Article information
Abstract
목적
이전에 콘택트렌즈 사용이 없었던 환자에서 단기간의 치료 소프트콘택트렌즈 삽입 후 발병한 가시아메바 각막염을 그람염색으로 진단하고 치료하였기에 이를 보고하고자 한다.
증례요약
첫 번째 증례는 세균과 곰팡이의 혼합 감염으로 초기 진단되었으나 각막찰과물의 그람염색으로 가시아메바로 진단되어 치료받은 후 빠른 호전을 보였다. 두 번째 증례로 초기 진단에 안검의 이물에 의한 지속성 각막상피결손으로 치료받다가, 다시 바이러스성 포도막염으로 진단되었으나, 병변이 악화된 후 시행한 그람염색으로 가시아메바 각막염으로 진단되어 치료받았으나, 지체된 진단과 치료로 시력감소가 심했다. 두 증례 모두에서 polyhexamethylene biguanide와 chlorhexidine 점안 약제로 치료했다.
결론
치료 소프트콘택트렌즈는 각막상피의 치유를 위해 흔히 사용하는 대표적인 방법이고 경험적 항생제의 점안과 함께 사용되나, 본 증례처럼 일반적인 배양검사로 진단되지 않고 경험적 항생제의 치료 범위에서 벗어나는 가시아메바 각막염의 경우는 초기 진단이 매우 중요하다. 초기 진단에 사용되는 그람염색은 경험적 항생제로 치료되지 않는 가시아메바의 진단 방법으로 매우 유용하다.
Trans Abstract
Purpose
We report two cases of Acanthamoeba keratitis diagnosed by Gram staining in patients who had recently worn therapeutic, soft contact lenses and had no history of lens use for visual correction.
Case summary
The first patient was initially diagnosed with suspected mixed bacterial or fungal keratitis before a final diagnosis of Acanthamoeba keratitis was confirmed by Gram staining of a corneal smear. The second patient was initially diagnosed with a persistent epithelial defect caused by an earlier lid injury inflicted by a metallic foreign body, and then with a suspected mixed infection combined with herpetic uveitis. The patient was finally diagnosed with Acanthamoeba keratitis by Gram staining of a corneal smear. Both cases were treated with polyhexamethylene biguanide and chlorhexidine.
Conclusions
Therapeutic, soft contact lenses are used to enhance corneal, epithelial wound healing in conjunction with antimicrobial prophylaxis. However, application of such a lens to a diseased cornea may predispose to the development of microbial keratitis caused by microorganisms resistant to the usual, prophylactic, antimicrobial eye drops. Therapeutic, soft contact lenses are associated with a risk of Acanthamoeba keratitis; early diagnosis is important. Gram staining of a corneal smear is useful in this context. Acanthamoeba is not eradicated by empirical broad-spectrum antimicrobials.
치료 소프트콘택트렌즈는 각막미란, 수포각막병증, 안구표면의 각막굴절교정술, 각막의 미세천공과 같은 안구표면 질환에서 상피결손의 치유 속도를 증가시키고 통증을 감소시키기 위해 흔히 사용된다[1]. 콘택트렌즈 재질과 디자인의 개선 및 예방적 항생제의 사용과 보급된 위생교육에 의해 콘택트렌즈와 관련된 세균각막염의 위험은 많이 줄었으나 여전히 각막염의 발생에 대한 주의 깊은 관찰이 필요하다[2]. 안과에서 치료 소프트콘택트렌즈를 처방할 때 흔히 경험적 항생제를 같이 처방하지만, 경험적 항생제에 감수성이 없는 미생물인 경우나, 항생제를 점안하는 환자의 순응도, 그리고 각막에 도달하는 농도가 치료 용량에 미치지 못한 경우 등은 여전히 각막염의 큰 위험으로 남아있다[1,3]. 가시아메바는 경험적 항생제로 치료되지 않으므로 빠른 진단이 필요하다. 비교적 간단하게 시행되는 그람염색으로 진단한 치료용 소프트콘택트렌즈 착용 후 발생한 가시아메바 각막염의 증례보고를 하고자 한다.
증 례
이 연구는 성빈센트병원의 기관연구심의위원회의 승인을 받았다(승인 번호: VC20ZISE0010).
증례 1
35세 여자 환자가 좌안의 통증으로 응급실을 거쳐 내원하였다. 초진 시 좌안의 최대교정시력은 0.1이었다. 환자는 손톱으로 각막에 상처를 입은 후 치료를 위해 타안과에서 치료용 소프트콘택트렌즈를 3일간 착용하다가 통증이 악화되어 내원하였다. 환자는 이전에 시력교정을 위한 소프트 콘택트렌즈를 사용한 과거력은 없었다. 초진 시 이미 타안과에서 소프트콘택트렌즈를 제거하고 와서 렌즈 제조회사에 대한 정보는 없었으나, 환자의 과거력 청취에서 렌즈 착용 시작부터 moxifloxacin 0.5% 그리고 무보존제 인공누액(sodium hyaluronate 0.1%)을 점안해왔다고 했다. 초진 시 세극등현미경 소견에서는 각막전반에 걸친 소수포 및 상피 불규칙성과 데스메막주름과 함께 매우 작은 각막기질의 침윤이 관찰되었다(Fig. 1A).
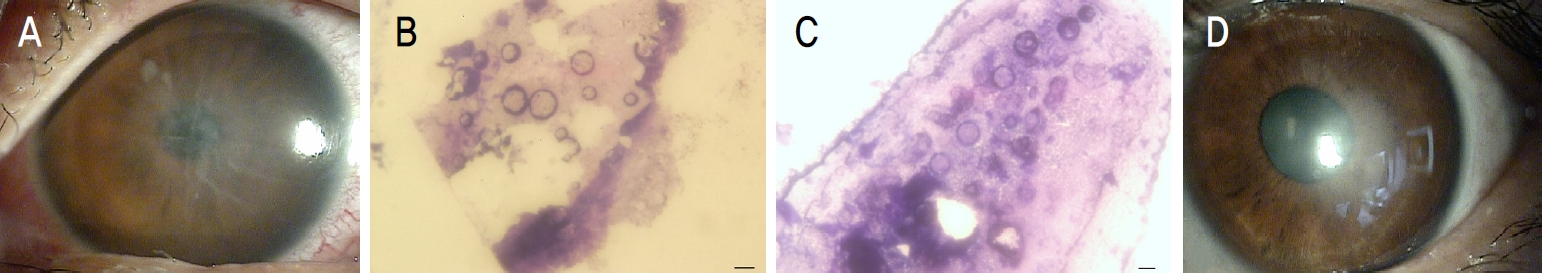
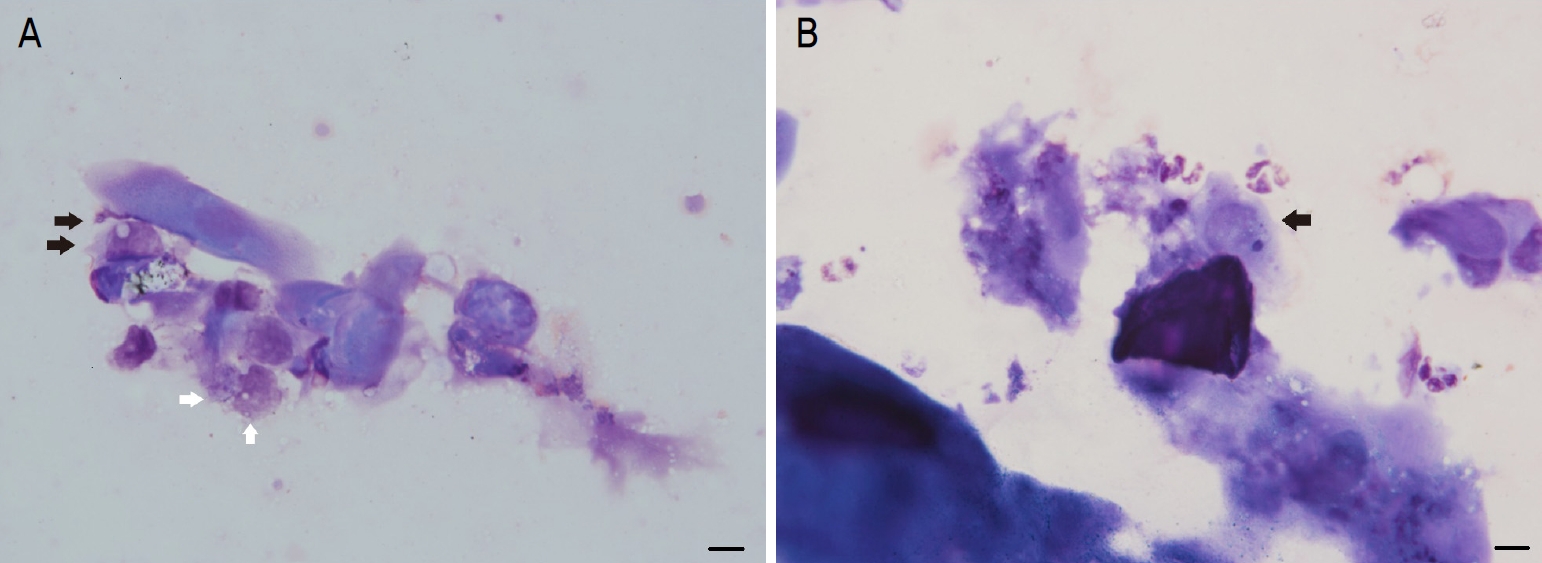
Case 1. (A) Biomicroscopic examination showed diffuse corneal microbullae and irregularity with Descemet’s folds and round stromal infiltration. (B, C) Acanthamoeba cysts in the corneal scraping (scale bar 10 μm, Gram stain, ×1,000). (D) Biomicroscopic examination showed faint corneal opacity after complete treatment at final follow up.
각막병변의 세균 배양검사를 위한 각막 중심부의 찰과 및 도말을 시도했고, 이때는 그람염색은 시도했으나, 일반적으로 세균각막염 의심하에 행해지는 진단검사의학과의 판독(그람양성 혹은 그람음성)에만 의존하여 현미경하에서 가시아메바 관찰의 시도가 되지 않았다. 항생제 점안액 moxifloxacin 0.5% (Vigamox, Alcon Korea, Seoul, Korea)와 tobramycin 0.3% (Tobra, Samil Pharm, Seoul, Korea)를 1시간 간격으로 점안했다. 각막배양검사의 최종 결과에서는 음성이었다. 내원 2일째부터 항진균제인 voriconazole 2% (Vfend, Pfizer Korea, Seoul, Korea)를, 내원 5일째부터는 natamycin 5% (Natacyn, Alcon, Purrs, Belgium)를 같이 점안하였다. 항진균제 사용 1주일 후에도 좌안의 각막은 호전이 없었고 환자는 여전히 시력감소와 더불어 통증을 호소하였다. 세균이 아닌 미생물에 의한 감염이 의심되어, 각막찰과를 다시 한 번 시행하여 그람염색을 진단검사 의학과에 의뢰하여 다음과 같이 시행하였다.
각막찰과물을 유리 슬라이드에 도포하여 올려놓고 상온에서 건조시킨 후 95% 메탄올로 2분간 고정한 후 흐르는 물에 세척하였다. 고정시킨 도말표본은 그람염색을 시행하였다. 그람염색은 crystal violet으로 염색 후 세척, 그 이후 Gram’s iodine으로 처리 후 세척했다. 그리고 95% 에탄올로 탈색 후 세척, 다시 사프라닌 용액으로 대조 염색 후 세척의 과정을 거쳤다.
광학현미경검사에서 각막찰과물에 있는 가시아메바의 다수의 포낭이 관찰되었다(Fig. 1B, C). 환자는 chlorhexidine 0.02% (Hexamedin, BuKwang Pharm, Seoul, Korea)와 polyhexamethylene biguanide (PHMB) 0.02% (HumanBio. Co., Seoul, Korea)의 점안약으로 약 3개월간 치료를 하고 점차 회복되어 최종 경과 관찰 때 최대교정시력 0.5까지 회복되었다(Fig. 1D).
증례 2
35세 여자 환자가 좌안의 통증과 함께 시력감소를 호소하여 응급실 통해 진료받았다. 초진 시 최대교정시력은 0.2였고, 환자 진술로는 약 3주간 항생제 및 스테로이드를 포함한 항염제 안약에도 불구하고 악화와 호전을 반복했다고 했다. 환자는 이전에 시력교정용 소프트콘택트렌즈를 사용한 적이 없었으며 안검에 박힌 금속성 이물의 제거 및 그로인한 각막찰과상으로 타안과에서 치료받는 도중 약 두 차례의 1주일간 치료 소프트콘택트렌즈를 사용했다고 했다. 그동안 사용했던 소프트렌즈의 제조 회사에 대한 정보는 얻을 수 없었고, 응급실 진료에서 안검 이물에 의한 각막찰과상으로 진단받아서 다시 새로운 소프트콘택트렌즈(Acuvue Oasis®, Johnson & Johnson, Jacksonville, FL, USA)를 처방받아 사용했다. 안약으로는 moxifloxacin과 tobramycin 점안약을 2시간 간격으로 사용했고, 아트로핀 안약 하루 2회로 사용했다.
응급실 진료 이후 2일째 환자의 세극등현미경 소견에서의 각막은 부채꼴 모양의 각막기질의 침윤과 1+의 전방 염증 그리고 심한 상안검의 부종을 보였다(Fig. 2A, B). 사용하던 콘택트렌즈는 제거하여 세균 및 곰팡이 배양을 하였고(최종 결과는 음성으로 나왔다), 다른 안약 추가 없이 매일 경과 관찰을 했다. 약 3일 후 각막침윤은 변화가 없었으나 환자의 전방염증은 +3으로 늘어나서, 외상에 의한 포도막염이나 단순포진 바이러스각막염 등을 의심하여 사용하던 안약에 추가하여 경구용 스테로이드를 처방하고, 50% 자가혈청 안약 점안을 시도했다. 그 다음날 환자는 통증의 감소를 표현했고, 그 이후 약 2주간 경과 관찰이 되지 않았다. 2주 후 환자가 다시 안과를 방문했을 때 좌안의 세극등 현미경검사에서 심한 고리 모양이 각막기질의 침윤과 상피미란 그리고 각막 후면 침착물을 보였다(Fig. 2C). 각막병변의 심한 악화에 다시 각막찰과를 시도하여 그람염색을 시행하였다. 광학현미경하에서 가시아메바의 포낭이 관찰되었다(Fig. 3). Chlorhexidine과 PHMB 점안 치료가 시작되었고, 차츰 호전을 보였으나, 약 3개월 후에도 최대교정시력은 0.08 정도에서 더 회복되지 않았다(Fig. 2D).
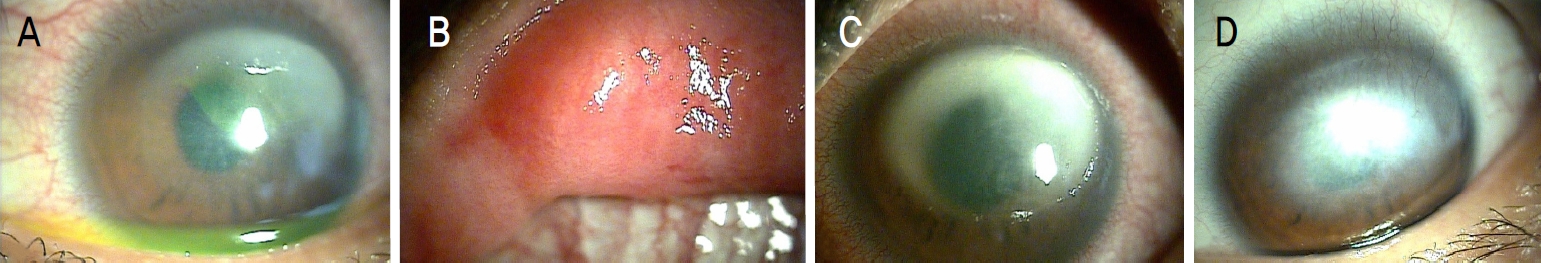
Case 2. (A) Biomicroscopic examination showed corneal epithelial defect with sectorial stromal infiltration. (B) Severe upper lid edema. (C) Biomicroscopic examination showed entire ring infiltration and an enlarged epithelial defect with keratic precipitate. (D) Biomicroscopic examination showed remained dense corneal opacity after 3 months treatment since diagnosis of acanthamoeba keratitis.
고 찰
콘택트렌즈는 세균각막염의 주된 위험인자이다[1-3]. 하지만 치료 소프트콘택트렌즈는 통증을 조절하고 상피의 치유를 가속화시킬 수 있어서 드물지 않게 사용된다. 만약 콘택트렌즈와 관련된 각막침윤을 보인다면 이 침윤이나 각막병변이 무균의 면역질환인지, 미생물 감염에 의한 것인지 감별이 필요하다[1].
대개의 콘택트렌즈에 관한 미생물 연구에서는 콘택트렌즈 자체에 생기는 미생물의 군락은 흔하지만, 각막에 감염각막염을 나타내는 것은 그보다 낮은 빈도로 나타났다[4]. 하지만 각막상피가 손상되고 미생물이 그 아래쪽 각막기질로 잘 침투될 수 있는 상태의 병든 각막에 콘택트렌즈가 위치하게 된다면 세균이나 곰팡이의 접근이 더 용이해질 수 있다[5]. 최근 연구에 의하면 콘택트렌즈에 의한 각막염의 발생 빈도는 렌즈의 재질에 의해 차이를 보이는 것으로 보고되었다[1]. 점안 스테로이드 약제나 싸이클로스포린과 같은 면역억제제도 국소적인 각막의 면역을 악화시켜서 세균각막염을 더 악화시킬 수도 있다[3,6].
각막굴절교정술 후의 통증 완화를 위해 착용한 치료 소프트콘택트렌즈에 의한 가시아메바 각막염의 보고도 있다[7,8]. 수술에 의한 국소 면역의 약화, 스테로이드 점안제의 사용, 그리고 소프트콘택트렌즈의 착용 등이 모두 가시아메바 각막염을 유발시킬 가능성이 있는 위험인자로 작용할 수 있다.
본 연구의 증례 2의 경우는 국소 스테로이드가 안검부종은 완화시켰지만, 각막병변은 악화시킨 것으로 생각된다. 또한 포도막염으로 오진된 상태에서 사용된 경구 스테로이드는 더욱 면역력 약화 및 질병의 진행을 조장했던 것으로 생각되며, 각막상처에 의한 통증으로 오진된 상태에서 상피치유를 위해 사용된 자가혈청 점안액은 환자의 일시적인 통증 감소를 유발하고 진단을 더욱 어렵게 만들어 병변의 악화를 유발했다.
본 연구의 두 증례 모두에서 단기간의 치료 소프트콘택트렌즈를 사용했음에도 불구하고, 가시아메바 각막감염이 되었으며, 정확한 초기 진단이 지체되어 치료가 늦게 시작되었다. 그람염색은 각막찰과물만으로 짧은 시간 내에 진행할 수 있으므로, 임상 소견이 강력히 의심된다면 병변의 첫 배양검사를 위한 각막찰과 시 그람염색을 시행한다면 가시아메바 각막염의 빠른 진단이 가능할 것이다.
가시아메바의 진단에는 많은 진단법이 있으나, 그중 빠른 시간 내에 할 수 있는 것으로는 그람염색과 아크리딘 오렌지 염색이 있다. 두 방법 모두 표본을 고정시키기 위한 여러 단계의 절차가 필요하기는 하나, 빠른 시간 내에 치료에 필요한 결과를 얻을 수 있다. 하지만 아크리딘 오렌지는 형광현미경이 필요하므로, 광학현미경으로 가장 간편하게 진단에 이용할 수 있는 것은 그람염색이나 습윤 도말검사이다. 습윤 도말검사는 그람염색에 비해 대비감도가 떨어진다[9-11].
그람염색은 1884년 Christian Gram이 처음 염색 방법을 기술한 이후, 새로운 추가 방법들이 소개되어 왔으며, 감염성 질환에 기본적이며 널리 사용되는 염색 방법으로 배양검사를 얻기 전에 그 결과를 빨리 알 수 있으므로 원인균의 분류 및 치료제 선택에 중요한 지침이 된다[9-11]. 그람염색의 가시아메바 진단에서의 민감도는 약 60%, 특이도는 100%로 보고되어 있다[12]. 각막염의 기본 염색으로 흔히 시행되고 있으며 특히 포낭의 염색이 잘 되어 가시아메바의 존재 유무를 확인하는 데 효율적인 진단 방법이다. 치료 소프트 콘택트렌즈의 재질로 최근 많이 사용되는 실리콘 하이드로젤 콘택트렌즈는 산소투과율이 높지만, 실리콘 하이드로젤 재질의 렌즈의 세부 재질의 분류 및 특성에 따라 가시아메바의 부착 정도가 달라서 각막염의 발생 및 진행에 영향을 줄 수 있다[13].
대개 치료 소프트콘택트렌즈 사용 시에는 예방적 항생제로 quinolone 계열을 사용한다[1,2,7]. 비록 콘택트렌즈가 곰팡이나 가시아메바의 위험인자라는 것을 알고 있지만, 예방적 항생제가 이러한 미생물을 사멸할 수 없고[8], 독성이 강한 점안 항진균제나 항아메바제를 예방적으로 같이 처방하는 경우는 드물 것이다. 따라서 빠른 진단 이후에 진단된 미생물의 감수성에 따라 안약을 빨리 투여하는 것이 가장 최선의 치료로 생각된다. 이러한 빠른 진단에 그람염색은 많은 도움이 될 것이므로 널리 사용될 것을 제안한다.
Notes
The authors have no conflicts to disclose.