양안 시신경염 형태로 발병된 비전형적 다발경화증
Atypical Multiple Sclerosis Presenting as Bilateral Optic Neuritis
Article information
Abstract
목적
비전형적인 증세를 보이는 양안 시신경염 환자에서 다발경화증을 진단하고 치료한 증례를 보고하고자 한다.
증례요약
34세 여자 환자가 3주 전 급성 척수염 증세와 2주 전 양안 시력저하 소견으로 신경과에서 다발경화증 의증하 고용량 스테로이드 정맥 요법을 받았으나 시력호전이 없어 안과에 의뢰되었다. 초진 시 최대교정시력 양안 모두 0.04, 좌안의 대구심동공운동장애와 Ishihara 색각검사에서 양안 1/17, 안저검사상 시신경유두부종은 관찰되지 않았다. 뇌 및 척수 자기공명영상의 T2 강조영상에서 전두엽 피질하 백질, 양안 시신경 교차 부위 및 좌측 구후 시신경 분절, 연수와 C2에서 C5 분절에 길게 걸친 고강도 신호가 관찰되었다. 혈청검사에서 항아쿠아포린-4 항체(aquaproin-4 immunogloblin G antibody [AQP4-IgG Ab])는 음성이었다. 경구 스테로이드 복용 후 1달째 양안 시력 1.0/0.8로 향상되었고, 이후 4년 동안 인터페론 베타를 유지하며 재발 없이 지내던 중 추적 소실되었다.
결론
심한 시력저하가 동반된 양안 시신경염은 다발경화증에서 드문 형태로, 철저한 진단 과정을 통해 유사질환을 배제하여 올바른 치료를 해야 할 것이다.
Trans Abstract
Purpose
We report a case of multiple sclerosis with bilateral optic neuritis that was atypical in terms of both the clinical signs and symptoms.
Case summary
A 34-year-old female visited the department of neurology with a complaint of sudden-onset, left lower extremity weakness and numbness that had developed 3 weeks prior, and bilateral blurred vision that had commenced 2 weeks prior. The patient was diagnosed with multiple sclerosis and prescribed high-dose intravenous methylprednisolone for 3 days, but the blurred vision did not improve. The patient was referred to the ophthalmology department. The initial best-corrected visual acuity was 0.04 in both eyes, and the relative afferent pupillary defect test was positive for the left eye. The Ishihara color test scores were 1/17 for both eyes. No optic disc swelling was evident on fundus examination. Brain and spine magnetic resonance imaging (T2-weighted) performed during the initial visit revealed lesions of high signal intensity in the frontal, subcortical white matter; the optic chiasm; the left retrobulbar optic segment; the medulla; and the spinal C2-5 processes. Aquaproin-4 immunogloblin G antibody (AQP4-IgG Ab) was not detected in serum. One month after prescription of the oral steroid, the vision improved to 1.0 in the right and 0.8 in the left eye. The patient was lost to follow-up after prescription of interferon-beta for 4 years, without recurrence.
Conclusions
Binocular optic neuritis accompanied by severe visual loss is a rare form of multiple sclerosis. A thorough diagnosis (with a focus on exclusion) is required, as is appropriate treatment.
젊은 성인에서 중추신경계 탈수초질환 중 가장 흔한 형태인 다발경화증(multiple sclerosis, MS)은 뇌, 척수, 또는 시신경에 만성적으로 반복되는 자가면역성 탈수초질환으로, 병변이 시간과 공간적 측면에서 여러 번(dissemination in time, DIT), 여러 부위(dissemination in space, DIS)에서 발생됨을 특징으로 지닌다. 침범되는 위치에 따라 다양한 임상양상을 보일 수 있는데, 그중 시신경염은 약 20%에서 다발경화증의 초기 증후로, 50%에서 병의 경과 중에 발생될 수 있어 안과 의사로서 주의를 요한다[1].
일반적으로 다발경화증 연관 시신경염(MS-optic neuritis [ON])의 경우 구후시신경염이 흔하며, 단안의 급성 시력저하, 안구운동 시 통증, 색각 및 시야 이상 등의 증세를 보인다[1]. 하지만 비전형적 시신경염 증세를 보이는 경우에는 동양에서 다발경화증보다 발생 빈도가 더 높은 시신경척수염 범주질환(neuromyelitis optica spectrum disorder, NMOSD), myelin oligodendrocyte glycoprotein immunogloblin G (MOG-IgG) 양성 시신경염 등 다른 중추신경계 탈수초질환과의 감별이 중요한데, 각각 질병특이항체를 지니는 특징이 있으나 음성인 경우가 있어 감별진단이 어려울 수 있다[1-3]. 특히, 인터페론 베타(interferon-beta)나 글라티라머아세테이트(glatiramer acetate)를 조기에 다발경화증 환자에 적용할 경우 임상단독증후군(clinically isolated syndrome)에서 다발경화증으로의 전환이나 자기공명영상검사상 새로운 T2 병변의 발생을 줄일 수 있으나, 인터페론 베타, 나탈리주맙(natalizumab), 핑골리모드(fingolimod)와 같은 다발경화증의 치료를 neuromyelitis optica (NMO)-IgG 양성 시신경염에 적용할 경우 질환의 경과를 악화시킬 수 있다[1-3]. 본 증례에서 저자들은 젊은 성인 환자에서 비전형적인 양안 시신경염을 보이는 드문 형태의 다발경화증을 NMOSD과 감별하고 적절히 치료한 증례를 경험하였기에 이를 보고하는 바이다.
증 례
본 증례 보고는 가톨릭대학교 여의도성모병원의 임상연구윤리위원회(IRB)에 의해 면제되었다(승인 번호: SC21ZESE0039).
특이 기저 질환이 없는 34세 여자 환자가 3주 전 갑자기 시작된 좌측 하지 감각저하와 보행 장애, 2주 전부터 배뇨 장애와 함께 1주 간격으로 좌안에서 우안으로 진행되는 양안 시력저하를 호소하였다. 이에 신경과에서 다발경화증 의증하 고용량 스테로이드 Methylprednisolone (Predisol® 250 mg, 4 times/day, 3 days) 정맥 치료를 시행하였고, 이어 경구 스테로이드 유지 중에 양안 시력저하가 호전되지 않아 치료 후 4일째 안과에 의뢰되었다.
안과 초진 당시 최대교정시력은 양안 모두 0.04였고, 좌안의 상대구심동공운동장애(relative afferent pupillary defect, RAPD)와 Isihara 색각검사에서 양안 1/17가 관찰되었다. 안저검사상 시신경유두부종은 관찰되지 않았으며(Fig. 1A), 망막신경섬유층촬영상 양안 망막신경섬유층(retinal nerve fiber layer) 및 신경절세포층(ganglion cell layer, GCL) 두께는 정상 범위였다(Fig. 1B, C). 문양 시유발전위검사로는 양안(특히 우안) P100 잠복기 지연을 보였고, 험프리 시야 검사에서는 양안 이측 반맹 소견이 보였다(Fig. 1D).

A fundus photograph, retinal nerve fiber layer (RNFL) and ganglion cell complex (GCC) optical coherence tomography (OCT), and visual field test of the patient taken at the initial visit. (A) Fundus photography shows no disc swelling in both eyes. (B, C) RNFL and GCC OCT show no decreased thickness of RNFL and ganglion cell layer (GCL). (D) Humphrey field analyzer shows bitemporal hemianopsia. IPL = inner plexiform layer; OD = oculus dexter; OS = oculus sinister.
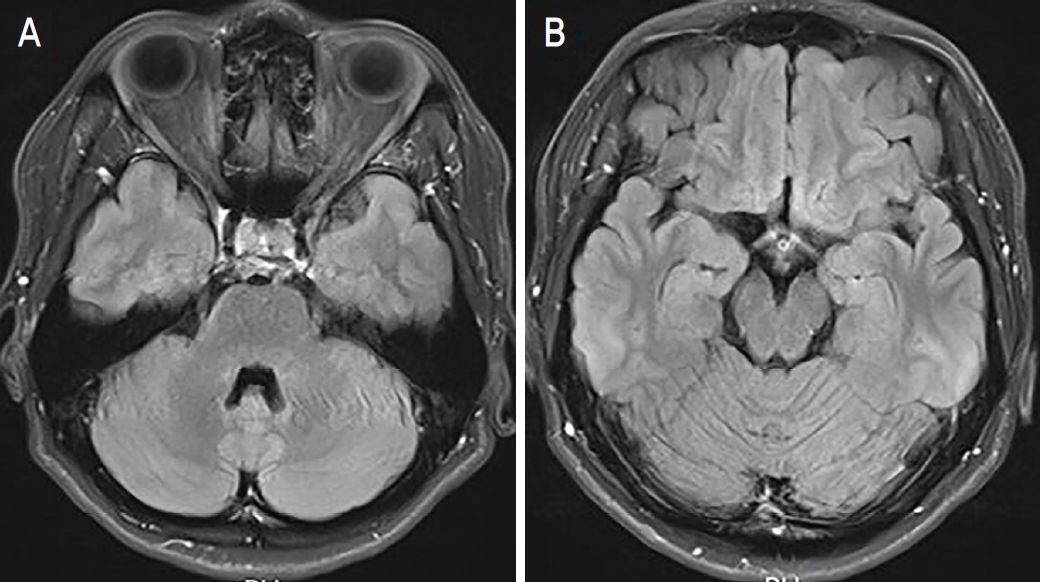
신경과 입원 시 시행한 뇌자기공명영상검사의 T2 강조영상에서 뇌량, 양측 전두엽 피질하백질, 우측의 연수 및 교뇌, 소뇌각에 다발성의 고강도 신호가 관찰되었으며, 양안 시신경 교차 부위 및 좌측 구후 시신경 분절에 고강도 신호가 보였다(Fig. 2A). 척수 자기공명영상검사의 T2-fluid attenuated inversion recovery (FLAIR) 강조영상에서는 연수와 C2에서 C5 분절에 길게 걸친 고강도 신호가 관찰되었다(Fig. 2B). 혈청검사에서 항아쿠아포린-4 항체(AQP-4 IgG Ab) 및 자가항체 음성, 뇌척수액검사에서 올리고클론띠(oligoclonal band) 음성, 세포증가증(pleocytosis)은 관찰되지 않았으나, 알부민세포해리(albumincocytologic dissociation)를 보였다.

Brain magnetic resonance imaging (MRI) and cervical spine MRI of the patient taken at the initial visit. (A) Brain MRI shows high signal intensities at optic chiasm and left retrobulbar segment of optic nerve (white arrow) in axial T2-flair weighted image. (B) Cervical spine MRI shows high extensive edematous bright foci at C2-C5 segment and medulla oblongata of the lower brain (dashed white circle) in sagittal T2-flair weighted image.
신경과에서 고용량 스테로이드 정맥 치료 후 경구용 Prednisolone (Solondo Tab®, Yuhan Corp., Chungju, Korea) 60 mg을 시작으로 1주일 단위로 50 mg, 40 mg, 30 mg, 20 mg, 10 mg으로 감량하여 복용하였다. 스테로이드 치료 1달 후 급성 척수염 증세는 호전되었고, 최대교정시력 우안 1.0, 좌안 0.8이었으며, 좌안 RAPD 양성, 색각검사는 우안 12/17, 좌안 6/17이었다. 안저검사상 시신경유두부종이나 창백은 없었다(Fig. 3A). 망막신경섬유층촬영상 GCL 두께는 감소되었으며(Fig. 3B), 험프리시야검사에서 양안 이측 반맹 소견은 다소 호전되었다(Fig. 3C). 발병 5개월 후부터 약 4년 동안 신경과에서 인터페론 베타(Rebif®, Merck Serono, Geneva, Switzerland)를 유지하였고, 발병 1년째 시행한 추적 뇌자기공명영상검사상 이전의 T2-FLAIR 강조 영상에서 관찰된 다발성 고강도 신호는 호전되었다(Fig. 4). 발병 후 4년째 간헐적 유토프 현상(uhthoff’s phenomenon)을 보였으나 시력저하 등의 재발 소견 없이 지내던 중 추적 소실되었다.
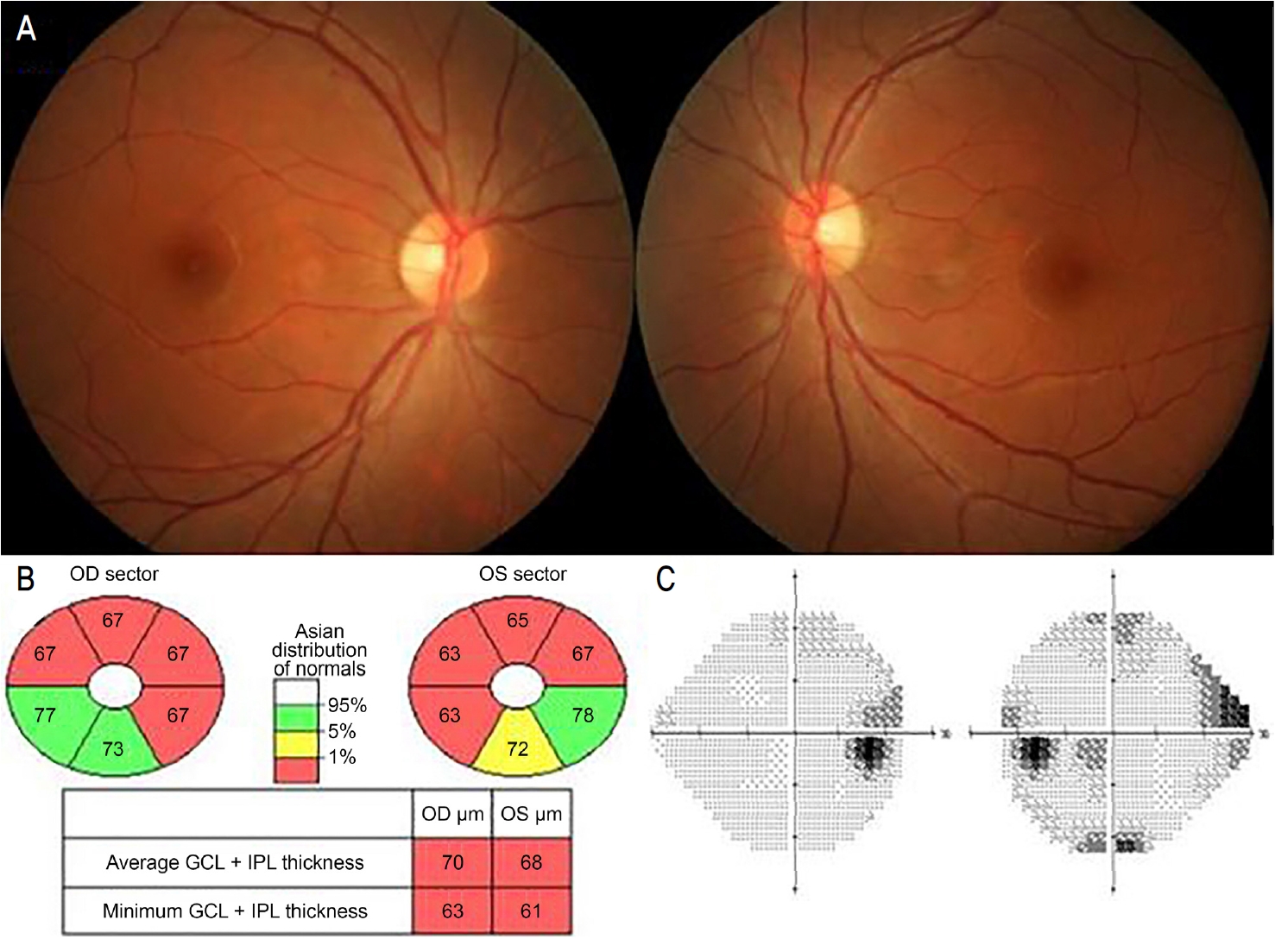
A fundus photograph, ganglion cell complex (GCC) optical coherence tomography (OCT), and visual field test of the patient 1 month after treatment was completed. (A) Fundus photography shows no disc swelling in both eyes. (B) Ganglion cell layer (GCL) thickness was decreased in the GCC OCT in both eyes. (C) In Humphrey field analyzer, bitemporal hemianopsia shown at the initial visit improved. IPL = inner plexiform layer; OD = oculus dexter; OS = oculus sinister.
고 찰
시신경염이란 시신경에 발생되는 염증성 탈수초질환으로, 전형적으로 단안의 급성 시력저하, 안구운동 시 안구주위 통증, 시야 및 색각저하 등의 증세를 보인다[1,4]. 이의 대표적 원인으로 다발경화증이 있으나, 시신경염이 비전형적인 증세-즉, 안통이 동반되지 않거나, 발병 초기부터 시신경유두 창백을 보이는 경우, 병의 경과 진행 중 시력호전이 없고, 양안 발생 등을 보이는 경우에는 NMO-IgG 연관 NMOSD, MOG-IgG 양성 시신경염, 급성 파종성 뇌척수염(acute disseminated encephalomyelitis)과 같은 다른 중추신경계 탈수초질환, 자가면역질환 등 여러 원인과의 감별이 반드시 필요하다[1,2,5].
MS-ON은 말초 혈액의 T 림프구가 혈액뇌장벽을 통과해 중추신경계에 만성 신경 손상을 일으키게 되며 발생되는데, 2017년 개정된 McDonald Criteria에 의하면 증상과 병변이 DIS와 DIT이 있으며 다른 유사 질환이 배제된 경우(exclusion of diagnosis)를 말한다[3,5]. 반면, NMO-IgG 연관 시신경염(이하, NMO-ON)은 AQP4-IgG, 즉, 혈액뇌장벽의 구성 물질인 별아교세포(astrocyte)에 존재하는 AQP-4 단백질에 대한 자가면역항체로 인하여, MOG-IgG 연관 시신경염(이하, MOG-ON)은 중추신경계 신경수초(myelin)의 구성물질인 희소돌기아교세포(oligodendrocyte)의 표면 단백질에 대한 항체(anti-MOG Ab)로 인하여 중추신경계가 손상을 받으며 유발된다[4,6]. 두 항체 모두 다발경화증에서 발현되지 않으며, 각각 질병 특이적인 임상경과를 보이게 되나, AQP-4 Ab는 NMO-ON의 70% 가량에서만 발현되며, anti-MOG-Ab는 AQP-4 Ab 음성 환자군의 25%에서 발현하게 되어 정확한 임상양상의 파악과 적절한 진단법의 적용이 중요하다[2,4,6,7].
본 증례의 환자는 일반적인 MS-ON의 경과와는 달라 NMOSD와의 감별이 어려웠다. 전형적인 MS-ON의 경우 시력저하가 단안에 급성 또는 아급성으로 발생하여 수일에서 2주가량 진행하다 치료 여부와 무관하게 90% 이상에서 2-3주 이내로 자연 호전된다[1,5]. 초기 시력소실은 경한 경우(visual acuity 20/20)부터 심한 경우(광각무)까지 다양할 수 있다[1,5]. 하지만 본 증례의 환자는 비전형적인 양안 시신경염의 양상을 보였다. 발병 초기부터 심한 시력저하를 보이며 단안 발병 1주 후 빠르게 양안으로 진행되는 시신경염의 형태였다. 이는 MS-ON보다는 초기 시력소실이 더 심하며 양안성의 경향이 강한 NMO-ON의 경과와 더 가깝다[6].
또한 본 증례에서 자기공명영상 소견도 MS-ON보다는 NMO-ON을 더 시사한다. 뇌자기공명영상상 환자는 시신경 교차 부위를 침범하며 시야검사에서 이와 일치하는 양안 이측 반맹 소견을 보였는데, 이는 NMO-ON에 더 적합한 임상 소견으로, NMO-ON의 경우 시신경염이 양측 안구 뒤, 시신경 교차까지 길게 침범되어 MS-ON보다 발생 초기 양안에 더 심한 시력저하를 보이는 경향이 있다[2,3]. 더불어, 뇌자기공명영상상 피질하 백질에 다발성 고강도 신호를 보이는 점은 다발경화증과 일치하나, 뇌량, 우측의 연수 및 교뇌, 소뇌각 등 뇌실질에 광범위한 병변을 보이는 점과 척수 자기공명영상상 연수와 상부 경추 척수 분절 3개 이상에 걸친 긴 척수염 소견은 NMOSD의 진단에 더 가깝다[8]. 따라서 본 증례의 환자는 AQP-4 Ab는 음성이었음에도 임상적 소견과 영상검사에서 전형적인 다발경화증과 맞지 않아 ‘혈청학적 음성’ 시신경척수염범주질환(seronegative NMOSD) 가능성을 배제할 수 없었다.
그럼에도 다음과 같은 이유로 ‘혈청학적 음성’ 시신경척수염범주질환보다 다발경화증 진단 가능성이 더 높았다. 먼저, AQP-4 Ab 음성군의 25%에서 다발경화증으로 진단된 보고가 있으며[7], 본 증례에서 뇌척수액검사상 올리고클론띠 음성 소견만으로 다발경화증을 배제할 수 없었다. 뇌척수액검사에서 올리고클론띠(oligoclonal band) 양성 소견은 일반적으로 다발경화증을 더 시사하지만, MS-ON에서 올리고클론띠는 69-97% 가량에서만 양성으로 관찰되어 다발경화증임에도 올리고클론띠가 음성일 수도 있다[3]. 둘째로, 양안 시신경염 소견이 반드시 NMOSD를 시사하지는 않는다[3]. MS-ON에서도 드물게 양안성으로 발병된 증례가 보고되는데, Srikajon et al [2]의 증례 보고에서 20명의 다발경화증 환자 중 3명이 초기 시신경염 발병 시 양안이 동시에 침범되었다고 한다. 셋째, NMO-ON의 시력예후는 불량하며 고용량 스테로이드치료에 잘 반응하지 않아 혈장교환술까지 필요한 데 반해 본 증례에서 시력은 스테로이드치료 후 빠르게 회복되었다[6]. 넷째, 광범위한 횡단성 척수염(longitudinally extensive spinal cord lesion, LETM)은 NMO의 특징적인 소견이기는 하나, LETM 환자를 대상으로 한 코호트 연구에서 약 6.5%만이 ‘true seronegative’ NMO로 진단되었다[7]. 또한, 광범위한 시신경염(longitudinally extensive optic neuritis)이 NMO에서만 특징적인 소견은 아니며, 다발경화증의 23% 가량에서도 관찰될 수 있기에, 본 증례의 자기공명영상 소견만으로 NMO로 확정 진단을 내릴 수는 없었다[9]. 마지막으로, 본 증례의 환자는 4년간 인터페론 베타의 치료에도 시신경염이 재발하지 않았다. 인터페론 베타, 나탈리주맙, 핑골리모드는 다발경화증에서 재발과 질병의 활성도를 줄이기 위해 적용되는 면역억제 치료법으로, 이들이 NMOSD에 적용될 경우 심각한 부작용을 유발할 수 있다[2,10,11]. Palace et al [10]에서 다발경화증으로 오진된 NMOSD 환자에서 인터페론 베타를 적용한 경우 3년 뒤부터 AQP-4 Ab titer가 증가하는 경향을 보였으나 인터페론 베타를 중단한 뒤 AQP-4 Ab 수치는 감소하였고, Warabi et al [11]는 NMOSD에서 인터페론 베타가 사용될 경우 시신경과 척수의 염증 재발률이 더 높았으며 심각한 시신경-척수 탈수초 반응을 유발한다고 하였다.
본 증례의 제한점으로 환자가 시력저하 발병 3주 후에 지연 내원하여 정확한 발병 초기 시력 등 안과 검사가 이뤄지지 않았으며, MOG-ON은 자기공명영상검사에서 시신경 주변 연부 조직의 광범위한 염증 소견(perineural enhancement)을 특징으로 본 증례와는 구별되나 anti-MOG Ab에 대한 혈청학적 평가가 시행되지 않았기에 MOG-ON에 대한 완전 배제가 불가하였다는 점을 들 수 있다[12]. MOG Ab는 AQP-4 Ab가 음성인 non-MS ON과 연관되어 있으며, MOG-ON의 경우 NMO-ON보다 재발이 더 잦고 초기 시력은 낮을지라도 시력예후는 좋다[2,13,14]. Chen et al [14]의 보고에서 MOG-ON 발병 초기 시 평균 시력은 안전수지였으나 추적 관찰 시 0.63으로 향상되었다. 본 증례에서도 전형적인 NMO-ON과 다르게 고용량 스테로이드치료 후 시력이 1.0/0.8로 호전되었다. 이와 같은 경우 anti-MOG Ab 혈액 검사를 시행하는 것이 진단에 더 도움이 되었을 것으로 보인다. 또한, 다발경화증으로의 확진이 어려운 비전형적인 경우, Palace et al [10]에서 NMOSD에서 인터페론 베타가 적용될 경우 AQP-4 Ab 수치가 상승되는 점을 통해 인터페론 베타 치료 중에는 지속적인 AQP-4 Ab 추적 관찰이 진단에 도움이 될 것으로 사료된다.
시신경염의 원인에 따라 특징적인 임상 소견이 존재함에도 MS-ON과 NMOSD-ON을 완전히 감별하는 것은 어려울 수 있다[2,5]. 질환의 발병 후 자기공명영상촬영 시점에 따라 같은 질환이라도 환자마다 상이한 영상 소견을 보일 수 있으며, 각 질환마다 항상 전형적인 증세와 소견을 보이는 것은 아니다[2]. 또한 활발한 연구를 통해 두 질환의 차이점이 더욱 밝혀지고 있으나, 두 질환 모두 유병률이 낮고 전향적 연구를 설계하기 어렵기 때문에 정확한 연구가 아직 다 이뤄지지 않았다[3,15].
비전형적인 증세를 보이는 양안 시신경염은 다발경화증에서 드문 형태이다. AQP-4 Ab, anti-MOG Ab와 같은 질병특이항체검사와 함께 자기공명영상을 포함한 철저한 진단 과정을 통하여 유발 가능한 다양한 원인 질환을 감별 배제하고 정확한 치료를 적용하는 것이 시력예후 향상에 도움이 될 것이다. 추후 새로운 혈청학적 biomarker와 자기공명영상 기법의 발달을 통하여 각 질환의 특징적인 병리생태에 대한 이해가 더욱 필요할 것이다.
Notes
The authors have no conflicts to disclose.