심한 비증식당뇨망막병증에서 Calcium Dobesilate가 내측황반두께에 미치는 영향
Effects of Calcium Dobesilate on Inner Retinal Thickness in Severe Non-proliferative Diabetic Retinopathy
Article information
Abstract
목적
Calcium dobesilate를 복용한 심한 비증식당뇨망막병증 환자들의 복용 전후 내측황반부두께의 변화를 알아보고자 하였다.
대상과 방법
본원에서 심한 비증식당뇨망막병증으로 진단된 후 3개월 이상 calcium dobesilate를 복용하고, 경과 관찰된 28명 28안을 대상으로 약물 투여 전, 3개월 후 빛간섭단층촬영으로 측정한 중심망막두께, 전체황반부피, 내측황반부두께, 즉 망막신경섬유층(retinal nerve fiber layer, RNFL), 신경절세포층(ganglion cell layer, GCL), 내망상층(inner plexiform layer, IPL)의 두께 자료를 후향적으로 분석하였다. 동일한 조건의 bilberry dried extract을 복용한 대조군을 선정하여 비교하였다.
결과
환자군에서 치료 전, 치료 후 3개월 시점에 측정한 중심망막두께와 전체황반부피는 치료 전과 비교하여 치료 3개월 경과 관찰 시점의 유의한 감소가 관찰되었다(p = 0.009, p = 0.010). 내측황반부두께는 106.31 ± 8.16 µm에서 105.18 ± 7.53 µm로 감소하였는데(p = 0.036), 그중 황반부신경섬유층, 황반부내망상층은 유의한 감소가 없었고(all p > 0.05), 황반부신경절세포층은 39.47 ± 3.61 µm에서 38.87 ± 3.21 µm로 유의하게 감소하였다(p = 0.012).
결론
심한 비증식당뇨망막병증 환자에서 calcium dobesilate 복용 후 3개월 경과 관찰 시에 내측황반부두께 감소가 관찰되었고 그중 신경절세포층은 유의한 두께 감소를 보였다.
Trans Abstract
Purpose
To investigate the effect of calcium dobesilate on inner macular thickness measured with optical coherence tomography in the eyes with severe non-proliferative diabetic retinopathy (NPDR).
Methods
The study participants were 28 patients (n = 28 eyes) who had severe NPDR without severe diabetic macular edema and who were followed up after treatment with calcium dobesilate for ≥ 3 months. Central macular thickness (CMT), total macular volume (TMV), and ganglion cell complex (GCC) at baseline and the 3 months follow-up were analyzed retrospectively. The matched patients with bilberry dried extract were selected and compared as a control group.
Results
In the calcium dobesilate group, the CMT and TMV measured before and 3 months after treatment were 265.36 ± 16.31 µm, 8.72 ± 0.45 mm3 and 262.39 ± 15.13 µm, 8.67 ± 0.46 mm3, respectively. A significant decrease in observation time was observed (p = 0.009, p = 0.010). GCC decreased from 106.31 ± 8.16 µm to 105.18 ± 7.53 µm (p = 0.036), of which retinal nerve fiber layer decreased from 34.27 ± 3.96 µm to 33.93 ± 3.80 µm (p = 0.219), and GCL from 39.47 ± 3.61 µm to 38.87 ± 3.217 µm (p = 0.012), inner plexiform layer changed from 32.56 ± 2.24 µm to 32.39 ± 2.14 µm (p = 0.211).
Conclusions
In patients with severe NPDR, a decrease in inner retinal thickness was observed after 3 months of taking calcium dobesilate, and the ganglion cell layer showed a significant decrease in thickness.
Protein kinase C 억제제[1], 레닌-안지오텐신 억제제[2], candesartan [3] 등 여러 약물들이 당뇨망막병증의 진행을 막거나 늦추기 위해 개발되어 왔다. 이런 약물들 중에서 모세혈관 강화제로 개발된 calcium dobesilate (Doxium®)는 calcium dihydroxy-2,5 benzenesulfonate로서 50여 년 전 당뇨망막병증 및 만성 정맥부전증 등의 치료 및 예방을 위해 개발되었고 현재 50개국 이상에서 널리 사용되고 있다[4,5].
당뇨망막병증과 관련하여 생각해 볼 수 있는 calcium dobesilate의 기전은 1) 항산화 효과로 인한 혈관투과성 조절, 혈관조직손상 저해 및 미세혈관의 투과성 감소[4,6-8], 2) nitric oxide 합성을 통한 혈관내피세포의 이완[4,9], 3) 혈액망막장벽 보호[5], 4) 혈액 점도 개선[5] 등이 있으며 항산화효과와 혈관 보호효과는 그동안 여러 연구에서 보고되었다[6,10-12]. 그중에는 calcium dobesilate가 혈관내피세포성장인자(vascular endothelial growth factor)의 과발현을 억제한다는 보고가 있는데[13-15], 이러한 약리학적인 기전은 calcium dobesilate가 당뇨망막병증 환자에서 혈액망막 장벽(blood retinal barrier)을 안정화시킬 수 있음을 시사한다.
비증식당뇨망막병증에서 calcium dobesilate 복용 후 빛간섭단층촬영(optical coherence tomography, OCT) 상 황반부두께가 감소한다는 보고가 있으나[16], 심한 비증식당뇨망막병증 환자들에서 OCT를 이용한 정량적 분석을 통한 내측황반부두께 변화에 대한 보고는 아직 없다. 따라서 저자는 본 연구를 통해 calcium dobesilate를 복용한 환자들의 복용 전후 OCT상 황반부 내층의 황반부신경절세포복합층(macular ganglion cell complex, GCC)의 두께 변화를 고찰해 보고자 하였다.
대상과 방법
2021년 1월부터 2021년 12월까지 본원에서 심한 비증식 당뇨망막병증으로 진단된 후 calcium dobesilate (Doxium®; Ilsung Pharmaceuticals Co., Seoul, Korea)를 복용한 환자와 bilberry dried extract (Qretin®; Taejoon Pharm Co., Seoul, Korea)을 복용한 대조군을 대상으로 의무기록을 후향적으로 분석하였다. 환자 중 calcium dobesilate를 복용하면서 3개월 이상 경과 관찰되고, 당뇨망막병증 이외의 안과적 질환이 없으며, 매질혼탁에 의한 안저 관찰 저해가 심하지 않고, 심한 당뇨황반부종이 없는 28명 28안을 대상군으로 포함시켰다. 대조군으로는 본원에서 bilberry dried extract (Qretin®; Taejoon Pharm Co.)를 처방받고 3개월 이상 경과 관찰된 환자 중 대상군 환자와 성별, 나이(± 4년), HbA1C (± 0.5%), 추적 관찰 기간(± 2개월)을 맞춘 환자를 짝지어 비교 분석하였다. 치료 시작 전 빛간섭단층촬영(OCT) 상 중심망막두께가 300 µm 이상인 환자는 두 군 모두 대상에서 제외하였다. 해당 연구 내용은 한길안과병원 생명윤리위원회의 승인을 받아 진행되었다(승인 번호: 22003).
치료군인 28명 28안은 calcium dobesilate (Doxium®; Ilsung Pharmaceuticals Co.) 250 mg을 1일 2회 복용하였으며, 대조군 28명 28안은 bilberry dried extract (Qretin®; Taejoon Pharm Co.) 170 mg을 1일 2회 복용하였다. 산동 후 시행한 형광안저촬영과 안저검사를 통해 Early Treatment Diabetic Retinopathy Study (ETDRS) grade에 따른 비증식성 당뇨망막병증의 병기를 평가하였다. 모든 대상 환자는 약물 투여 전, 3개월 후에 각각 OCT (Spectralis® OCT; Heidelberg engineering Inc., Heidelberg, Germany)를 시행하였다. 중심망막두께(center macular thickness)와 전체황반부피(total macular volume)는 빛간섭단층촬영으로 측정하여 내장된 소프트웨어에서 자동 분석한 수치를 이용하였고, 중심망막두께는 빛간섭단층촬영에서 측정된 ETDRS subfield에서 중심소와를 중심으로 하는 직경 1 mm 이내의 평균 망막두께로 정의하였다. 전체황반부피는 중심와를 기준으로 6 mm 직경의 망막을 9구역으로 나누어 측정한 망막두께로부터 자동 계산된 값을 이용하였다. 본 연구에서는 황반부신경섬유층(retinal nerve fiber layer, RNFL), 황반부신경절세포층(ganglion cell layer, GCL), 황반부내망상층(inner plexiform layer, IPL) 각 층의 6 mm 직경 내의 부피 정보를 내장된 소프트웨어를 통해 구한 후, 이를 6 mm 직경 원의 넓이에 해당하는 9π mm2로 나누어 6 mm 직경 영역의 각 층별 평균 두께를 계산하였다. 그리고 황반부신경절세포복합층(macular GCC)의 두께는 황반부신경섬유층, 황반부신경절세포층, 황반부내망상층, 세 층의 두께를 합산하여 계산하였고, 황반부신경절세포복합층 두께를 내측 황반부의 두께로 정의하였다.
통계 처리는 SPSS statistics ver. 25.0 (SPSS Inc, Chicago, IL, USA)을 사용하였으며, p < 0.05인 경우 통계적으로 유의한 것으로 간주하였다.
결 과
대상군에 포함된 환자는 총 28명 28안, 남자 15안 여자 13안이었으며, 평균 연령은 63.93 ± 8.9세, 평균 혈중 HbA1C는 7.75% ± 1.24%였다(Table 1). 치료 전 중심망막두께는 265.36 ± 16.31 µm, 전체황반부피 8.72 ± 0.45 mm3였다. 대조군으로 포함된 28명 28안도 남자 15안 여자 13안이었으며, 평균 연령 63.50 ± 9.3세, 평균 혈중 HbA1C는 7.63% ± 1.48%였다. 치료 전 중심황반두께는 265.25 ± 18.23 µm, 전체황반부피 8.68 ± 0.36 mm3였다. 대상군과 대조군 사이에 성별, 나이, 중심황반두께, 전체황반부피 사이의 유의한 통계적 차이는 없었다(p > 0.05).
대상군에서 치료 3개월 시점의 중심망막두께는 262.39 ± 15.14 µm, 전체황반부피 8.67 ± 0.46 mm3였다. 대조군에서 치료 3개월 시점의 중심망막두께는 263.43 ± 18.12 µm, 전체황반부피 8.65 ± 0.36 mm3였다. 대상군은 치료 전후 중심망막두께 및 전체황반부피의 유의한 감소가 있었으나 대조군은 유의한 차이가 없었다(Table 2).
대상군과 대조군 내에서 각각 치료 전과 치료 후 3개월 시점의 황반부신경절세포복합층 두께 지표들의 변화에 대한 통계분석을 시행하였다(Table 3, Fig. 1). 해당 분석에서 대상군 내의 치료 전과 치료 후 3개월 경과 관찰 시점 사이의 황반부신경절세포복합층 두께의 유의한 감소가 관찰되었고(p = 0.036), 그중 황반부신경절세포층 두께가 유의하게 감소하였다(p = 0.012). 대조군에서는 황반부신경절세포복합층, 황반부신경섬유층, 황반부신경절세포층, 황반부내망상층 두께 모두 유의한 변화가 없었고, 각 시점별 대상군과 대조군 사이에 유의한 차이는 관찰되지 않았다(all p > 0.05).
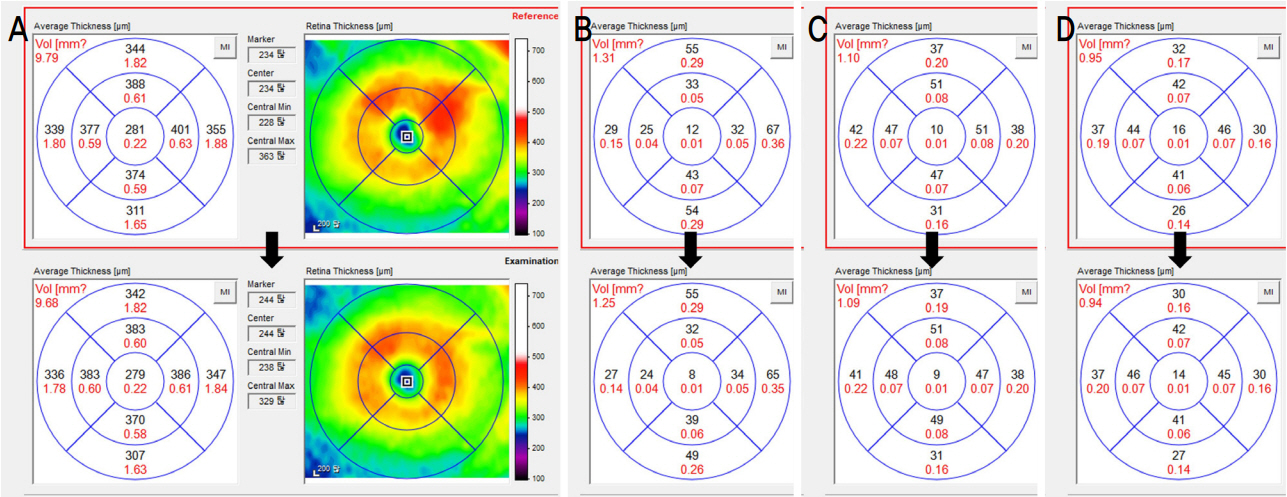
Representative case. Images from a 69-year-old male with severe non-proliferative diabetic retinopathy. After 3 months of taking the calcium dobesilate, the central macular thickness (CMT) and total macular volume (TMV) decreased from 281 µm, 9.79 mm3 to 279 µm, 9.68 mm3. The thickness of retinal nerve fiber layer (RNFL), ganglion cell layer (GCL), and inner plexiform layer (IPL) corresponding to ganglion cell complex also decreased. (A) CMT and TMV, (B) RNFL, (C) GCL, and (D) IPL.
고 찰
본 연구에서는 심한 당뇨황반부종이 관찰되지 않는 비증식당뇨망막병증 환자에서 calcium dobesilate가 내측망막의 두께 변화에 미치는 영향을 비교적 짧은 기간 동안 알아보고자 하였다. 복용 전 후 3개월간 경과 관찰 시 중심망막두께, 전체황반부피, 황반부신경절세포복합층의 유의한 감소가 관찰되었고, 황반부신경절세포복합층 중 황반부신경절세포층 두께의 감소가 유의하였다.
억제하여 모세혈관의 과투과성을 낮춰 부종을 개선한다는 보고가 있고[5], 항산화효과가 있어 망막혈관의 투과성을 감소시키고[4,6,9,17,18], 혈액망막 장벽을 안정화시킨다[7,8]는 보고들이 있다. 아울러, 혈액응고에 관여하는 인자의 저하를 통해 혈액의 과도한 점성을 억제하여 혈류를 개선한다는 보고도 있었고, 약 복용 후 monocyte chemoattractant protein-1, intercellular adhesion molecule 등 혈중 염증 인자 농도의 감소를 보고하기도 하였다[5].
망막의 내층 황반부에는 황반부신경절세포복합층이 존재하는데, 황반부신경섬유층, 황반부신경절세포층, 황반부내망상층으로 구성되어 있다. 이들은 각각 망막신경절세포의 축삭(axon), 세포체(cell body), 수상돌기(dendrite)에 해당한다. 황반부의 superficial vascular plexus는 황반부신경절세포층에 위치하는데 망막 동맥 및 정맥이 관찰되는 부위이다. 본 연구에서 황반부신경절세포복합층의 두께가 감소된 것은 당뇨망막병증으로 인한 황반부 내층의 망막혈관의 투과성 감소 및 혈액망막 장벽의 안정화와 관련이 있을 것으로 추정된다. 신경절세포인 황반부신경절세포층의 두께만 유의한 감소를 보이고 황반부신경섬유층이나 황반부내망상층의 유의한 두께 변화는 관찰되지 않았는데, 황반부신경절세포복합층 중 황반부신경절세포층 두께만 감소한 정확한 이유를 알기 어려워 추후 이에 대한 추가 연구가 필요해 보인다.
본 연구는 연령, 성별, 당화혈색소, 당뇨망막병증의 정도에 따라 매칭 대조군을 설정하여 본 연구의 제한점을 최소화하려고 하였으나, 후향적 연구로 진행되었으며 연구 대상수가 적었다는 제한점이 있다. 후향적 연구 설계로 인해, 위약이 아닌 다른 약제(bilberry dried extract) 복용군과의 비교를 수행하여, 위약 대비 독시움의 효과를 정확히 비교하기 어려웠다는 점 역시 제한점이라 할 수 있다. 두 번째로, 3개월이라는 짧은 경과 관찰로 인해 망막두께에 미치는 약의 정확한 영향을 알아보기 어려웠을 수 있다. 하지만 경과 관찰이 길 경우 calcium dobesilate 외 여러 가지 요인이 비뚤림으로 작용하여 약제의 영향을 정확히 평가하기가 더 어려울 수 있다는 점을 고려하였다. 이상의 여러 제한점에도 불구하고, 본 연구는 calcium dobesilate 복용 전후 빛간섭단층촬영을 이용한 정량적 분석을 통해 내측황반부두께 변화를 본 최초의 보고이며, 심한 당뇨황반부종이 없는 비증식당뇨망막병증 환자에서 약 복용 전후 유의한 황반부신경절세포복합층의 감소를 볼 수 있었다.
Notes
The authors have no conflicts to disclose.
This research is supported by Ilsung Pharmaceutical.


