|
 |
| Ann Optom Contact Lens > Volume 20(3); 2021 > Article |
|
Abstract
몊ě
미ěŠěšëŁěŠ ęł ěśë Ľ Nd:YAG ë ě´ě ě ě°ě°í ë
¸ěśë ě´í ë°ěí íŠë°ëłěŚ íěěě 쥰기 ě 댏체ę°ë´ ííę´ë´íźěąěĽě¸ěí체 ěšëŁëĽź ëł´ęł íęł ě íë¤.
ěŚëĄěě˝
36ě¸ě ěŹě íěę° ë´ě ěźěŁźěź ě 미ěŠěšëŁěŠ ęł ěśë Ľ Nd:YAG ë ě´ě ě ë
¸ěśë ě´í ë°ěí ě°ěě ěë Ľě í뼟 죟ěëĄ ë´ěíěë¤. íěě ě°ě ěľëęľě ěë Ľě 0.1ě´ěęł ěě ę˛ěŹěěë ě°ě ě¤ěŹě ë§ë§íěśí ěę˛Źě´ ę´ě°°ëěë¤. ëšę°ěë¨ě¸ľě´Źěěě ě°ě ě¤ěŹě ë§ë§íěśíëĄ ě¸í ěĽěĄë§ë§ë°ëŚŹ ë° ë§ë§ěěěíź-ë¸ëŁ¨íŹë§ ëłľíŠě˛´ íě´ ě겏ě ę´ě°°í ě ěěë¤. ě´ě ëí´ ě´ ě¸ ë˛ě ęą¸ěł ě 댏체ę°ë´ ë˛ ë°ě죟ë§(AvastinÂŽ, 1.25 mg/0.05 mL; Roche Korea, Seoul, Korea) 죟ěŹě ě ěííěë¤. 6ę°ě í ěë Ľě ě´ę¸° ë´ě ěě ëłíę° ěěěźë, ëšę°ěë¨ě¸ľě´Źěěě ě°ě ě¤ěŹě ë§ë§íěśí íĄě ěę˛Źě´ íě¸ëěęł ě´ě°¨ěą 맼ë˝ë§ě ěíę´ě ë°ěě´ë 맼ë˝ë§ěśíě ěŹë° ě겏ě ëł´ě´ě§ ěěë¤.
Abstract
Purpose
To report a follow up of early intravitreal anti-vascular endothelial growth factor (VEGF) antibody treatment in a patient with maculopathy after accidental exposure to a high-powered cosmetic Nd:YAG laser.
Case summary
A 36-year-old female patient visited our clinic with decreased visual acuity in the right eye after accidental exposure to a high-powered cosmetic Nd:YAG laser. The best-corrected visual acuity of the right eye was 0.1 and subretinal hemorrhage on the foveal area was observed during fundus examination. Optical coherence tomography revealed serous retinal detachment with hyperreflective disruption of the ellipsoid zone and retinal pigment epithelium-Bruchâs membrane complex. Intravitreal bevacizumab (AvastinÂŽ, 1.25 mg/0.05 mL; Roche Korea, Seoul, Korea) injections were performed three times. Visual acuity was unchanged at 6 months after the first visit. However, complete resolution of the subretinal hemorrhage was observed and there were no signs of secondary choroidal neovascularization or recurrence of choroidal hemorrhage.
ë ě´ě ěĽëšë íźëśęłźěě ë¤ěíę˛ íěŠëęł ěěźëŠ° 모ë°, ěěëłëł, 모ë°, íźëśíę´ëłëł, 돸ě ě ęą° ë° íźëśěŹě 몊ě ěźëĄ ěŁźëĄ ěŹěŠëë¤[1]. ě´ëŹí ë ě´ě ě ěęľŹę° ë
¸ěśë늴 ë§ë§ěěěźëĄ ě¸í ěę°ěĽě ę° ë°ěí ě ěěźëŠ°, ë ě´ě ě ę°ë ë° íěĽ, ë
¸ěś 기ę°ęłź ę°ě ěŹëŹ ěěě ë°ëź ë¤ěí ë§ë§ěěě ě ë°í ě ěë ę˛ěźëĄ ěë ¤ě ¸ ěë¤[2]. ë ě´ě ë
¸ěśëĄ ě¸í ë§ë§ěěěë ě¸ě¸Ąë§ë§íě´(outer retinal disruption), íŠë°ěśí(foveal hemorrhage), íŠë°ëśě˘
(macular edema), ë§ë§ě ë§(epiretinal membrane), ě 츾íŠë°ěęłľ(full thickness macular hole) ëąě íŹí¨íë¤[3].
ęšëšĄě ë°ěŹ ë° íě¤ë°ě(the blink reflex and aversion response)ě ë ě´ě ë
¸ěś ěę°ě 0.15-0.25ě´ëĄ ě íěí¤ë ěí ě íë¤. ꡸ëŹë ě´ëŹí ë°ěŹě ě¸ ëł´í¸ ëŠěť¤ëěŚě ěę°ě ě¸ ë
¸ěśěźě§ëźë ęł ěśë Ľ ë ě´ě ë
¸ěś ěěë ëší¨ě¨ě ě´ëŠ°, ěźěě ě¸ ë ě´ě ë
¸ěś íěë ěŹę°í ë§ë§ěěě´ ë°ěí ě ěë¤[4].
ęľë´ 돸íěě í´ëěŠ ë ě´ě íŹě¸í° ěĄ°ěŹ í ë°ěí ë§ë§ëłěŚ[5-7] ë° Nd:YAG ë ě´ě 뼟 ě´ěŠí íëě ę°ě ë° ě뼴곤ë ě´ě ę´ěęł ě ě´í ë°ěí ě´ě°¨ë§ë§ëłěŚě ëí ěŹëĄę° ëŞ ě°¨ëĄ ëł´ęł ë ë° ěěźë, 미ěŠěšëŁěŠ ęł ěśë Ľ Nd:YAG ë ě´ě ě ę´ěě ě°ě°í ë
¸ěśë ě´í ë°ěí ë§ë§ëłěŚě ëí´ěë ëł´ęł ë ë° ěë¤. ě´ě ě ěë¤ě 36ě¸ ěąě¸ěě 미ěŠěšëŁěŠ ęł ěśë Ľ Nd:YAG ë ě´ě ě ě°ě°í ë
¸ěśë ě´í ë°ěí ě¤ěŹě ë§ë§íěśíě ëí´ ííę´ë´íźěąěĽě¸ěí체(anti-vascular endothelial growth factor antibody)ëĄ ěĄ°ę¸° ěšëŁí ěŚëĄëĽź ëł´ęł íęł ě íë¤.
36ě¸ě ěŹě íěę° ë´ě ěźěŁźěź ě 1,064 nm íěĽ 0.427 gigawatt (GW)ě 미ěŠěšëŁěŠ ęł ěśë Ľ Nd:YAG ë ě´ě ě ě°ě°í ë
¸ěśë ě´í ë°ěí ě°ěě ěë Ľě í뼟 죟ěëĄ ë´ěíěë¤. íěë ëšě ë ě´ě ěě ě ěí í
ě¤í¸ ęłźě ě¤ ě§ě ě ě¸ ë
¸ěśě´ ěë ě˘
ě´ě ë°ěŹë ę´ěě ěę°ě ěźëĄ ë
¸ěśëěë¤ęł ě§ě íěë¤.
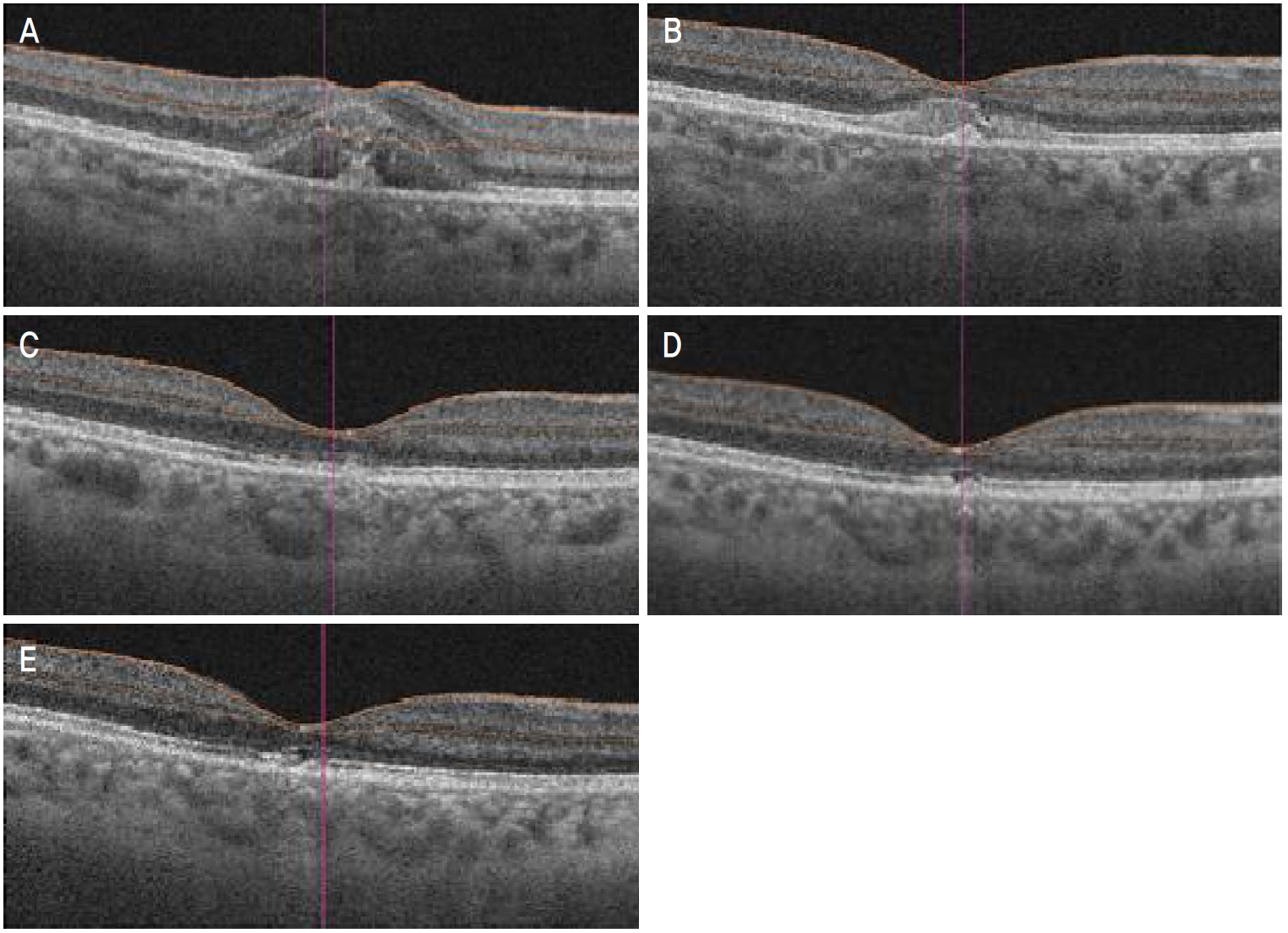
íě ęłźęą°ë Ľě ë´ęłźě ëłë Ľ ěěźëŠ°, ěęłźě ëłë Ľ ë° ěě ë Ľ ëí ěěěźëŠ°, ë´ě ëšě ěľëęľě ěë Ľě ě°ě 0.1, ě˘ě 1.0ě´ěęł , ëšě ě´ ěěęłëĄ 츥ě í ěěě ě°ě 16 mmHg, ě˘ě 13 mmHgěë¤. ě¸ęˇšëąí미경ę˛ěŹě 결ë§, ę°ë§, ě ë°Š, ëęłľ ë° ěě 체ë 모ë ě ěě´ěęł , ě°ëíěŹ ěíí ěě ę˛ěŹě ě°ěě 1ě ëě§ę˛˝ íŹę¸°ě ě¤ěŹě ë§ë§íěśíě´ ę´ě°°ëěë¤(Fig. 1A). ëšę°ěë¨ě¸ľě´Źě(optical coherence tomography)ěěë ě°ě ě¤ěŹě ë§ë§íěśíëĄ ě¸í ě ěěě ěĽěĄë§ë§ë°ëŚŹ ě겏 ë° ë§ë§ěěěíź-ë¸ëŁ¨íŹë§ íě´ëĄ ě¸í ěĽěĄë§ë§ë°ëŚŹ ě¤ěŹëśě ęł ěě ě겏ě ę´ě°°í ě ěěěźëŠ°(Fig. 2A), ëšę°ěë¨ě¸ľíę´ěĄ°ě(optical coherence tomography angiography)ěě ě¸ë§ë§ě¸ľęłź 맼ë˝ë§ëŻ¸ě¸íę´ě íëĽě íę° ę´ě°°ëěë¤(Fig. 1C). 맼ë˝ë§ě ěíę´ ě 돴뼟 íě¸í기 ěí´ íę´ěě íę´ěĄ°ěě (fluorescein angiography) ë° ě¸ëěŹě´ěë꡸댰íę´ěĄ°ěě (indocyanine green angiography)ě ěśę°ě ěźëĄ ěííěë¤. íę´ěě íę´ěĄ°ěěěë ë§ë§íěśíě ěí ě°ě ě¤ěŹě ě íę´ ě겏, ě¸ëěŹě´ěë꡸댰íę´ěĄ°ěěěë ë§ë§íěśíě ěí ě°ě ě¤ěŹě ě íę´ ě겏 ë° ě¤ěŹëśě ë§ë§ěěěíź-ë¸ëŁ¨íŹë§ íě´ëĄ ě¸í ě íę´ ěę˛Źě´ ëŻ¸ě¸íę˛ ę´ě°°ëěěźë ëë ˇí 맼ë˝ë§ě ěíę´ë§ě ę´ě°°ëě§ ěěë¤(Fig. 1E, F).
ě˛ě ë´ě í 1ę°ě, 2ę°ě, 3ę°ě, 6ę°ě째 경곟 ę´ě°° ěë§ë¤ ëšę°ěë¨ě¸ľě´Źě ë° ëšę°ěë¨ě¸ľíę´ěĄ°ěě ěííěŹ ě¤ěŹě ë§ë§íěśíě í¸ě ë° ěŹë° ěŹëś, 맼ë˝ë§ě ěíę´ě ě 돴뼟 íě¸íěěźëŠ° ě˛ě ë´ě ě, 1ę°ě, 2ę°ě째 ě´ ě¸ ë˛ě ęą¸ěł ě°ěě ě 댏체ę°ë´ ë˛ ë°ě죟ë§(AvastinÂŽ, 1.25 mg/0.05 mL; Roche Korea, Seoul, Korea) 죟ěŹě ě ěííěë¤. ě 댏체ę°ë´ ë˛ ë°ě죟ë§ěŁźěŹě ě ë ě°¨ëĄ ěí ě´í 2ę°ě째ëśí° ëšę°ěë¨ě¸ľě´Źěěě ě°ěě ě¤ěŹě ë§ë§íěśíě íĄě ě겏ě ëł´ěë¤(Fig. 2B). ěšëŁ ěě í 6ę°ě째 ěíí ěě ě´Źěěě ě¤ěŹě ë§ë§íěśíě ěě í íĄě ë° ě¤ěŹëśě ë°í ěę˛Źě´ ę´ě°°ëěěźëŠ°(Fig. 1B), ëšę°ěë¨ě¸ľíę´ěĄ°ěěě ě¸ë§ë§ě¸ľęłź 맼ë˝ë§ëŻ¸ě¸íę´ě íëĽë ę°ě ëěěźë ě¤ěŹëśě ë°í ěę˛Źě´ ę´ě°°ëěë¤(Fig. 1D). ë§ë§íěśíě ěŹë° ë° ë§Ľë˝ë§ě ěíę´ě 6ę°ěěŹ ę°ě 경곟 ę´ě°° ę¸°ę° ëě ë°ěíě§ ěěęł íě체꾏ě(ellipsoid zone) ë° ë§ë§ěěěíź-ë¸ëŁ¨íŹë§ ëłľíŠě˛´(retinal pigment epithelium-Bruchâs membrane complex)ě íě´ ě겏곟 í¨ęť 맼ë˝ë§ ë°í ěę˛Źě´ ëšę°ěë¨ě¸ľě´Źěěě ě§ěě ěźëĄ ę´ě°°ëěë¤(Fig. 2C-E). ěě 6ę°ě í ěľëęľě ěë Ľě 0.1ëĄ ě¸Ąě ëěë¤.
American National Standards Institute (ANSI)ě ë ě´ě 뼟 ěśë Ľě ë°ëź Class 1, 1M, 2, 2M, 3R, 3B, 4ëĄ ëśëĽíęł ěë¤. Class 3R ë ě´ě ě ę˛˝ě° 1-5 mW ěŹě´ě ěśë Ľě í´ëší늰 ANSI ě§ěš¨ě ë°ëź Class 3R ě´ěěěë ěë ¨ë ě´ěěě ę°ë
íě ěŹěŠíëëĄ ęśěĽíęł ěë¤[8]. Nd:YAG ë ě´ě ě ę˛˝ě° ěľë ěśë Ľě´ 100 mW ě´ěěźëĄ Class 3B ě´ěě ęł ěëě§ ë ě´ě ě í´ëšíëŻëĄ 죟ě ęšě ěŹěŠě ěíë¤. ę´ě ě 기본ě ě¸ ě¸ ę°ě§ 기ě ě¸ ę¸°ęłě , ě´, ę´ííě í¨ęłźëĄ ë§ë§ě ěěě ě¤ ě ěěźëŠ° ë ě´ě ě ěí ë§ë§ěěě 기ęłě , ě´ ěěě ěí´ ë§ë§ě¸ľě íę´´, ë§ë§ ë° ë§Ľë˝ë§ íę´ íě, ě§ě§ ęłźě°í ë°ěě´ ěźě´ë¨ěźëĄě¨ ë°ěíë¤ęł ěë ¤ě ¸ ěë¤[3]. ë ě´ě ě ěí ë§ë§ěěě 경꾏 ě¤í
ëĄě´ëě ë° íě°íě ę° íě°í ë° íěźěŚ í¨ęłźëĽź íľí´ íěĄ-ë§ë§ ěĽë˛˝ě ëł´ě íë ěí ě í¨ěźëĄě¨ ěšëŁě í¨ęłźę° ěě ę˛ěźëĄ ěę°ë늰, ě¤ě ëĄ ěë Ľę°ě ě´ ěěë¤ë ëŞëŞ ëł´ęł ę° ěěěźë ěë Ľěíě ę˛°ęłźę° ë¤ěíę˛ ëíëŹěźëŠ° íěŹ ěšëŁë˛ě´ ě 댽ëě´ ěě§ ěë¤[3,9-13].
ë ě´ě ě ěí´ ë§Ľë˝ë§íě´ě´ ë°ěíë ę˛˝ě° ě´ë ëë°ëë ë¸ëŁ¨íŹë§ íě´ě´ ë§ěą ěźěŚě ěźěźěź íę´ë´íźěąěĽě¸ě ëśëšëĽź ěíĽ ěĄ°ě í¨ěźëĄě¨ 맼ë˝ë§ě ěíę´ě ě ë°ěí¤ë ę˛ěźëĄ ěë ¤ě ¸ ěěźëŠ° 맼ë˝ë§íě´ íěě 10-20%ěě ë§ë§íěśí ë° ěĽěĄë§ë§ë°ëŚŹëĽź ëë°í 맼ë˝ë§ě ěíę´ě´ ë°ěíë ę˛ěźëĄ ëł´ęł ë ë° ěë¤[14]. 맼ë˝ë§ě ěíę´ě 맼ë˝ë§íě´ íěěě ěŹí ěë Ľěěě ěě¸ě´ ë ě ěë¤. Nd:YAG ë ě´ě ě ěí 맼ë˝ë§íě´ě ííę˛ ëł´ęł ëě§ ěěěźë ě¸ěěą ë§Ľë˝ë§íě´ íě뼟 ëěěźëĄ í ě°ęľŹěěë ěë Ľěíě ę´ë ¨ë ě¸ěę° ëł´ęł ë ë° ěëë°, Ament et al [15]ě 111ěě 맼ë˝ë§íě´ íě뼟 ëěěźëĄ í ííĽě ě°ęľŹěě ěë Ľěíě 맼ë˝ë§ě ěíę´ ë°ěě ě츥 ě¸ě뼟 ëł´ęł í ë° ěěźëŠ°, ě´ę¸° ěë Ľ ë° ěě ěěšę° ěë Ľěíě ě ěí ě°ę´ěąě ëł´ěěźëŠ° ęł ě°ë š ë° íŠë°ëś 맼ë˝ë§íě´ě´ 맼ë˝ë§ ě ěíę´ ë°ěęłź ę°í ě°ę´ěąě´ ěěěě ëł´ęł íěë¤. Liu et al [16]ěě íę´ë´íźěąěĽě¸ěě ěľě ë ěśí ěę° ë° ěęł ěę° ę°ě뼟 íľíěŹ ěśí íĄěěë í¨ęłźę° ěěě ëł´ęł íěë¤. ëí Kim et al [14]ě ě¸ěě ěí íŠë°ëś 맼ë˝ë§íě´ íěě ěë Ľě íě ěě´ ë§Ľë˝ë§ě ěíę´ ë°ě ě 쥰기 ë˛ ë°ěěŁźë§ ěŁźě
ě´ ë§ë§íěĄ ę°ě ë° ěë Ľí¸ě ě í¨ęłźě ě¸ ěšëŁëĄ ě ěí ë° ěë¤.
본 ěŚëĄěěë ě§ë¨ ě ëŞ
íí 맼ë˝ë§ě ěíę´ě ę´ě°°ëě§ ěěěźë ë§ë§íěśíě ěí ěŹí ěë Ľěěě ëł´ěë¤ë ě , ěě ëśěę° ě¤ěŹě뼟 íŹí¨í ě ě ęł ë ¤íěŹ ěśí 맼ë˝ë§ě ěíę´ ë°ěě ěíě´ ëë¤ęł íë¨íěěźëŠ° ě´ę¸° ěë Ľě´ 0.1ëĄ ě íëě´ ěě´ ěĄ°ę¸° ě 댏체ę°ë´ ë˛ ë°ě죟ë§(AvastinÂŽ, Roche) 죟ěŹě ě ěííěë¤. 첍 ë´ě í 2ę°ě째ëśí° ëšę°ěë¨ě¸ľě´Źě ë° ëšę°ěë¨ě¸ľíę´ě´Źěěěě ë ë ˇí ě°ě ě¤ěŹě ë§ë§íěśíě íĄě ě겏ě ëł´ěęł ë§ë§íěĄ íšě íŠë°íěśíě ěŹë° ě겏ě ę´ě°°ëě§ ěě ě 댏체ę°ë´ ë˛ ë°ěěŁźë§ ěŁźěŹě ě ěí í¨ęłźę° ěěěě ě ěśí´ ëłź ě ěěë¤.
íŠë°íěśí íĄě ě겏ěë ëśęľŹíęł ě¤ěŹě íě체꾏ě ë° ë§ë§ěěěíź-ë¸ëŁ¨íŹë§ ëłľíŠě˛´ě íě´ ě겏곟 í¨ęť 맼ë˝ë§ ěŹě¸ľëśě ë°í ě겏ě ě§ěëě´ ěë Ľě 0.1ëĄ ěśę° ę°ě ě ëł´ě´ě§ ěěë¤. ꡸ëŹë 본 ě°ęľŹë ęł ěśë Ľ 미ěŠë ě´ě ě ěí íŠë°ëś ěě ě ě 댏체ę°ë´ ë˛ ë°ě죟ë§ěŁźěŹě ě ě´ěŠíěŹ ě ěí íííě í¸ě ë° ë§Ľë˝ë§ě ěíę´ ë°ěě´ ěěěě íě¸íěë¤ë ě ěě í¨ęłźě ě¸ ěšëŁěě íě¸íěěźëŠ°, 본 íěë ě¤ěŹě 욨ë˛ě ěí´ ěë Ľěíë ě˘ě§ ěěěźë ě¤ěŹě ě¸ íŠë°ëś ěěě ę˛˝ě° ě 댏체ę°ë´ ë˛ ë°ě죟ë§ěŁźěŹě ě´ ěë Ľěíěë ëěě ě¤ ě ěě ę˛ěźëĄ ěŹëŁëë¤. ěśí 맼ë˝ë§íě´ íěěě ě 댏체ę°ë´ ë˛ ë°ě죟ë§ěŁźěŹě ě ěĽę¸°ě í¨ęłźě ëí´ěë ë§ě ěŚëĄëĽź íľí ě°ęľŹę° ë íěí ę˛ěźëĄ ěę°ëë¤.
Figure 1.
Fundus photograph (A) and optical coherence tomography angiography (OCT-A) (C) of right eye at initial visit. Fundus photograph shows subretinal hemorrhage on fovea (about 1 disc diameter sized) (A). OCT-A shows blood flow defects of the outer retinal layer and the choroidal capillaries (C). Fundus photograph (B) and OCT-A (D) of right eye after 6 months of treatment. Fundus photograph shows complete resolution of subretinal hemorrhage and central whitish scar on fovea (C). OCT-A shows recovery of blood flow defects but shows central whitish scar of the outer retinal layer and the choroidal capillaries (D). Fluorescein angiography (FA) imaging at initial visit shows significant hypofluorescence of macula by blockage by subretinal hemorrhage in patientâs right eye (E). Indocyanine green angiography (ICGA) imaging shows hypofluorescence on macula with central further low fluorescence corresponding to subretinal hemorrhage and disruption of retinal pigment epithelium-Bruchâs membrane (BM) complex on fovea in right eye (F). There were no signs of active choroidal neovascularization on FA or ICGA. IPL = inner plexiform layer; INL = inner nuclear layer.
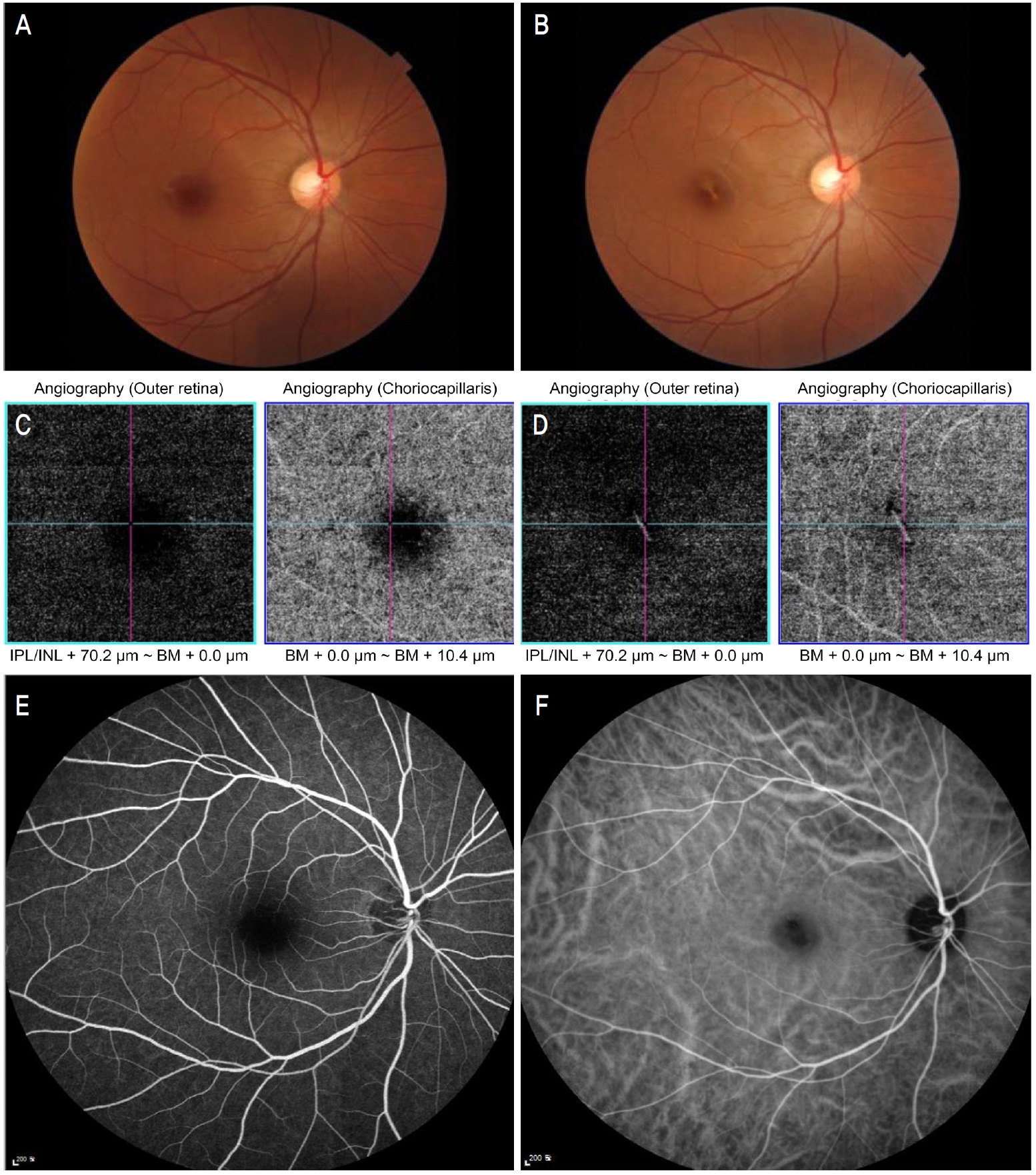
Figure 2.
Optical coherence tomography (OCT) follow-up imaging of post-intravitreal bevacizumab injection in the right eye (A-E). OCT at initial visit shows subretinal hemorrhage with pigment epithelial detachment of foveal area (A). OCT after 2 months of treatment shows partial resolution of subretinal hemorrhage and remaining pigment epithelial detachment (B). OCT after 3 months, 4 months, 6 months of treatment shows respectively complete resolution of subretinal hemorrhage, disruption of ellipsoid zone and retinal pigment epithelial-Bruchâs Membrane complex with deep choroidal scar (C-E).
REFERENCES
2) Chen YY, Lu N, Li JP, et al. Early treatment for laser-induced maculopathy. Chin Med J (Engl) 2017;130:2121-2.



3) Alsulaiman SM, Alrushood AA, Almasaud J, et al. High-power handheld blue laser-induced maculopathy: the results of the King Khaled Eye Specialist Hospital Collaborative Retina Study Group. Ophthalmology 2014;121:566-72.e1.


4) Rabiolo A, Sacconi R, Giuffrè C, et al. Self-inflicted laser handheld laser-induced maculopathy: a novel ocular manifestation of factitious disorder. Retin Cases Brief Rep 2018;12 Suppl 1:S46-50.


5) Kim YJ, Chung IY, Kim SJ, et al. A case of maculopathy from handheld green laser pointer. J Korean Ophthalmol Soc 2015;56:447-51.

6) Kim M, Kwon JW, Han YK. A case of green laser pointer injury to the macula. J Korean Ophthalmol Soc 2008;49:681-4.

7) Jeong WD, Hwang YH, Kim JS, Lee JH. Maculopathy from red laser pointer. J Korean Ophthalmol Soc 2007;48:1007-11.
9) Hirsch DR, Booth DG, Schocket S, Sliney DH. Recovery from pulsed-dye laser retinal injury. Arch Ophthalmol 1992;110:1688-9.


10) Balashevich LI, Zhokhov VP, Kirillov IuL, PreobrazhenskiÄ PV. Cases of eye injuries from laser radiation. Vestn Oftalmol 1981;1:60-1.
11) Cai YS, Xu D, Mo X. Clinical, pathological and photochemical studies of laser injury of the retina. Health Phys 1989;56:643-6.


13) Liu HF, Gao GH, Wu DC, et al. Ocular injuries from accidental laser exposure. Health Phys 1989;56:711-6.


14) Kim M, Kim JH, Seo Y, et al. Intravitreal bevacizumab for traumatic choroidal rupture. Optom Vis Sci 2015;92:e363-7.





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print